Содержание
- 2. План урока 1) Классификация веществ; 2) Неорганические и органические кислоты, основания, амфотерные соединения: - определения -
- 3. Вопросы для повторения Какие бывают вещества? (неорганические и органические) Классификация неорганических веществ (простые и сложные) Определение
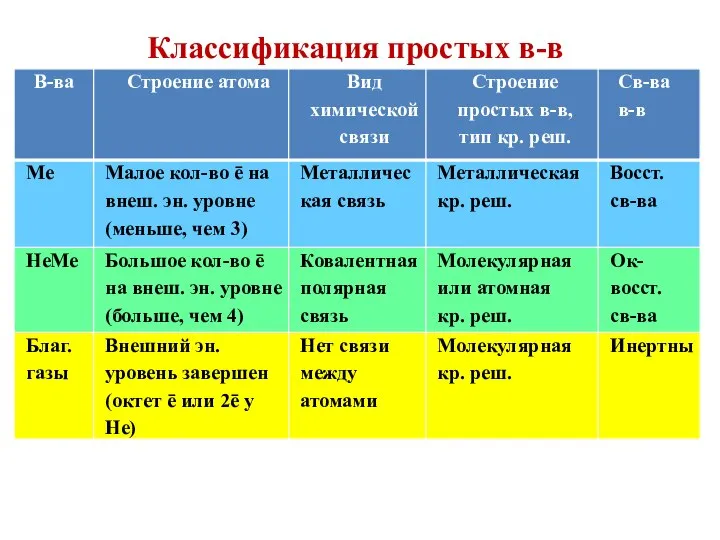
- 4. Классификация простых в-в
- 5. Классификация сложных веществ оксиды (несолеобразующие и солеобразующие: основные, кислотные и амфотерные) гидроксиды (кислоты, основания, амфотерные гидроксиды)
- 6. S8 AI(OH)3 H2SO3 NO BaO P2O5 HI табл. word Mg(OH)2 NaHSO3 (ZnOH)CI KNO3 KAI(SO4)2 Na3[AIF6] NH4Fe(SO4)2
- 7. Написать уравнения электролитической диссоциации NaHSO3→ (ZnOH)CI → KNO3 → KAI(SO4)2 → Na3[AIF6] → NH4Fe(SO4)2 →
- 8. Классификация органических веществ вид углеродной цепи (ациклические, циклические: карбоциклические, гетероциклические) наличие кратных связей табл. word
- 9. Неорганические и органические КИСЛОТЫ ОСНОВАНИЯ АМФОТЕРНЫЕ СОЕДИНЕНИЯ Определения: по структурной теории по электролитической теории по протолитической
- 10. Дайте характеристику по классификации и химическим свойствам след. веществ Сравните кислотные и основные свойства Н3РО4 H2SO4
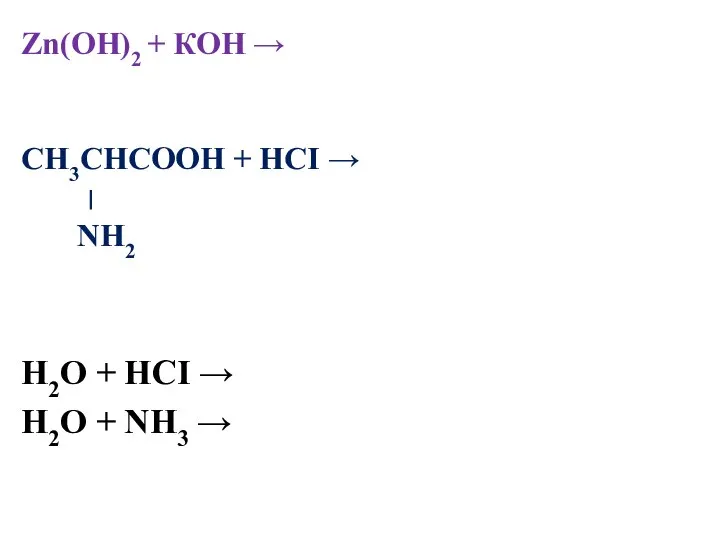
- 11. Допишите уравнения реакций H2SO4 + КОН → CH3COOH + Mg(OH)2→ NH3 + HCI → CH3NH2 +
- 12. Вывод: Общими свойствами для неорганических и органических кислот и оснований является их взаимодействие друг с другом,
- 13. Zn(OH)2 + КОН → CH3CHCOOH + HCI → ׀ NH2 Н2О + НСI → Н2О +
- 14. Вывод: Амфотерные свойства проявляют оксиды и гидроксиды переходных Ме, а не типичных Ме и типичных НеМе.
- 15. Генетическая связь неорганических соединений Составьте генетический ряд для след. элементов Ва Сu S Si
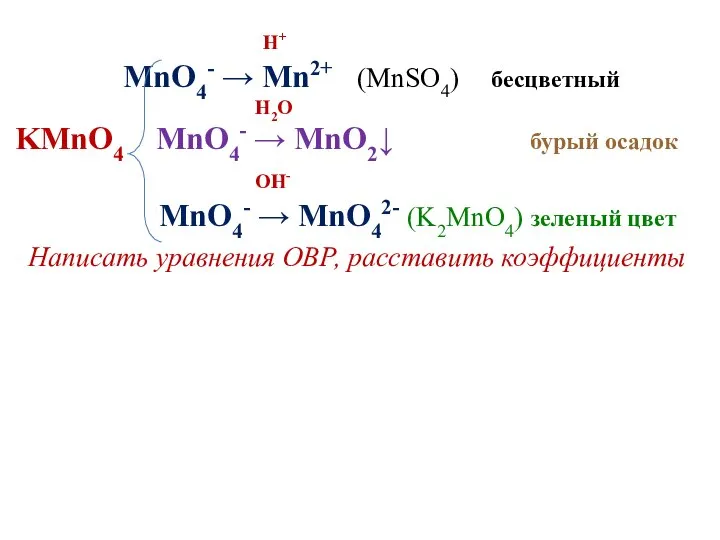
- 16. Практическое осуществление ОВР ОВР между KMnO4 и Na2SO3 в различных средах (кислой, нейтральной и щелочной) Объясните
- 17. H+ MnO4- → Mn2+ (MnSO4) бесцветный H2O KMnO4 MnO4- → MnO2↓ бурый осадок OH- MnO4- →
- 18. KMnO4 + H2SO4 + Na2SO3 → K2SO4 + MnSO4 + Na2SO4 + H2O KMnO4 + H2O
- 20. Скачать презентацию




![Написать уравнения электролитической диссоциации NaHSO3→ (ZnOH)CI → KNO3 → KAI(SO4)2 → Na3[AIF6] → NH4Fe(SO4)2 →](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1024794/slide-6.jpg)








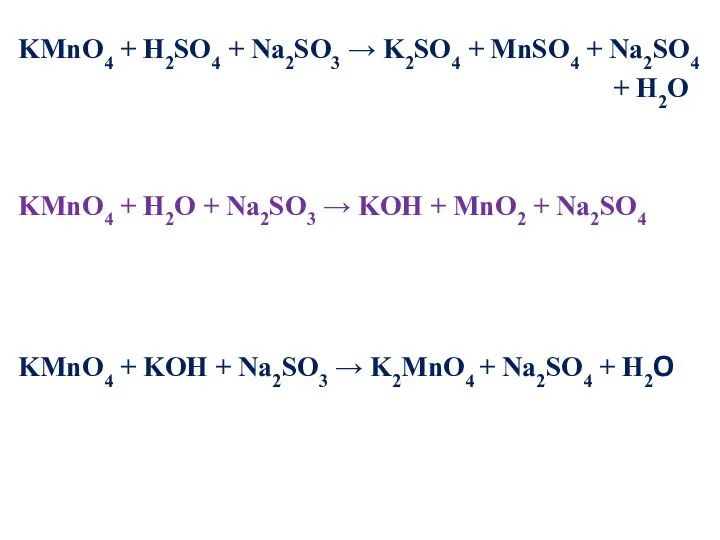
 Углеводы (сахара). Строение, свойства, участие в функционировании живых систем
Углеводы (сахара). Строение, свойства, участие в функционировании живых систем Каучук
Каучук Строение и функции нуклеиновых кислот. Лекция №3
Строение и функции нуклеиновых кислот. Лекция №3 Типы кристаллических решеток. Тест
Типы кристаллических решеток. Тест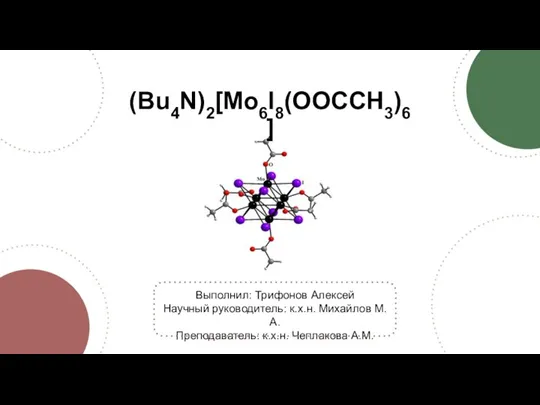 (Bu4N)2[Mo6I8(OOCCH3)6]. Синтез
(Bu4N)2[Mo6I8(OOCCH3)6]. Синтез Ионные уравнения. Кислоты, их классификация. 8 класс
Ионные уравнения. Кислоты, их классификация. 8 класс Лекция № 1
Лекция № 1 Инновационное производство синтетических мелкокодисперсных оксидов и оборудования для их изготовления
Инновационное производство синтетических мелкокодисперсных оксидов и оборудования для их изготовления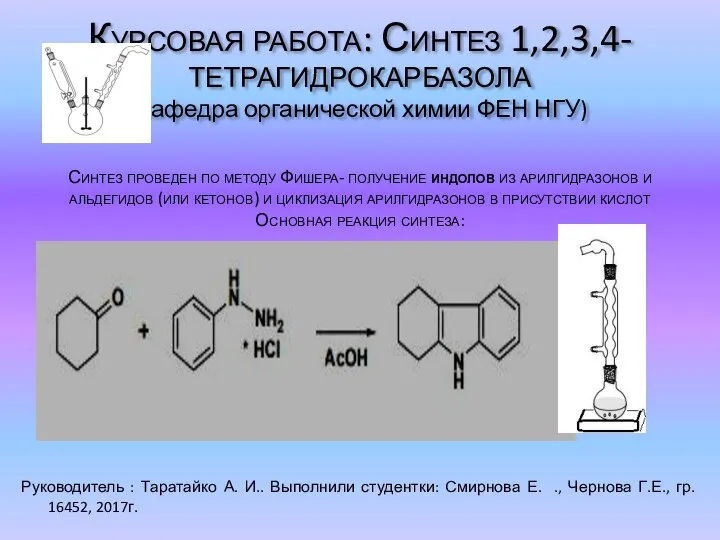 Синтез 1,2,3,4-тетрагидрокарбазола
Синтез 1,2,3,4-тетрагидрокарбазола Ресурс Лови оксиды для систематизации знаний, умений, навыков по теме Оксиды
Ресурс Лови оксиды для систематизации знаний, умений, навыков по теме Оксиды Химический процесс: энергетика и равновесие
Химический процесс: энергетика и равновесие Кремний и его соединения
Кремний и его соединения Проблемы и меры по защите окружающей среды ПМР
Проблемы и меры по защите окружающей среды ПМР Проект Chemical 3D
Проект Chemical 3D Высшие жирные кислоты липиды биомембраны. Лекция 3
Высшие жирные кислоты липиды биомембраны. Лекция 3 Растворы. Способы выражения концентрации растворенного вещества
Растворы. Способы выражения концентрации растворенного вещества Общая характеристика VIIА-группы – Галогены
Общая характеристика VIIА-группы – Галогены Решение задач по химическим уравнениям
Решение задач по химическим уравнениям Продолжение истории: 1933 год, Ленинград (Питер)
Продолжение истории: 1933 год, Ленинград (Питер) Кристаллическая структура вещества. Вывод формульных единиц по отношению масс элементов и по массовым долям элементов. (Урок №6)
Кристаллическая структура вещества. Вывод формульных единиц по отношению масс элементов и по массовым долям элементов. (Урок №6) Кислоты. Классификация кислот (8 класс)
Кислоты. Классификация кислот (8 класс) Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость
Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость Свойства черных и цветных металлов
Свойства черных и цветных металлов Канифоль. Физико-химические показатели
Канифоль. Физико-химические показатели Nevarne snovi
Nevarne snovi Синтетические органические соединения
Синтетические органические соединения Производные фенола: танины
Производные фенола: танины Серная кислота
Серная кислота