Содержание
- 3. Сокращенное название «аммиак» которым мы всегда пользуемся, ввел в обиход в 1801 году русский ученый -
- 4. Строение молекулы
- 5. NH3 N 1s2 2s2 2p3 + H N H H 3H H N 1s1 +δ +δ
- 6. Физические свойства (при н.у. ) бесцветный газ с резким характерным запахом (запах нашатырного спирта) легче воздуха
- 7. Получение аммиака Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония: 2NH4Cl +
- 8. Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота: N2(г) + 3H2(г) ↔ 2NH3(г)
- 9. Химические свойства аммиака Для аммиака характерны реакции: 1) с изменением степени окисления атома азота (реакции окисления);
- 10. с кислородом Горение аммиака (при нагревании) 4NH3 + 3O2 → 2N2 + 6H20 Каталитическое окисление аммиака
- 11. с оксидами металлов 2NH3 +3CuO =3Cu + N2 +3H2O
- 12. с сильными окислителями 2NH3 + 3Cl2 = N2 + 6HCl (при нагревании)
- 13. Взаимодействие с кислотами NH3 + HCl → NH4Cl 2NH3 +H2SO4 → (NH4)2SO4
- 14. Взаимодействие с водой NH3 + H2O = NH4OH При добавлении фенолфталеина‑ раствор становится малиновым, так как
- 15. Применение аммиака Производство пластмасс и волокон 2. В составе моющих средств
- 16. 3. Производство азотных удобрений 4. В сельском хозяйстве
- 17. 5. Производство азотной кислоты 6. Получение взрывчатых веществ
- 18. 7. В медицине
- 20. Скачать презентацию


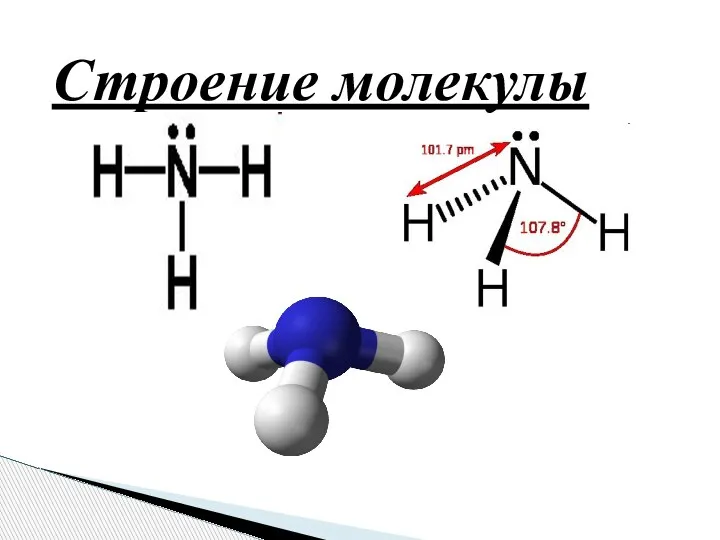
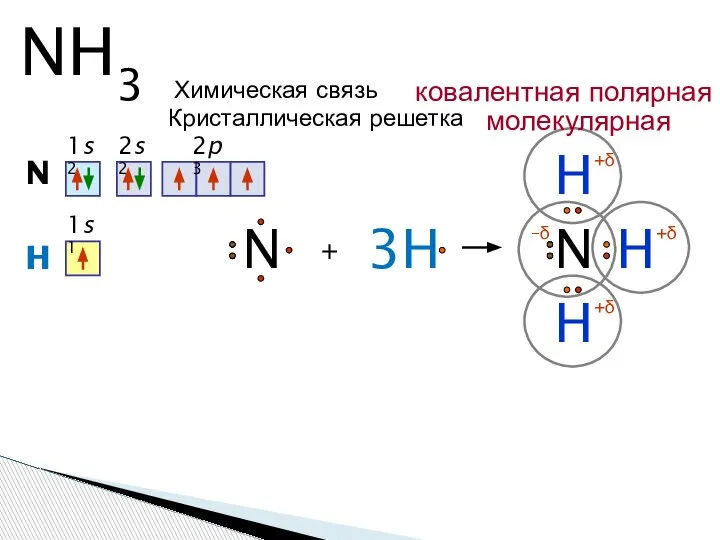




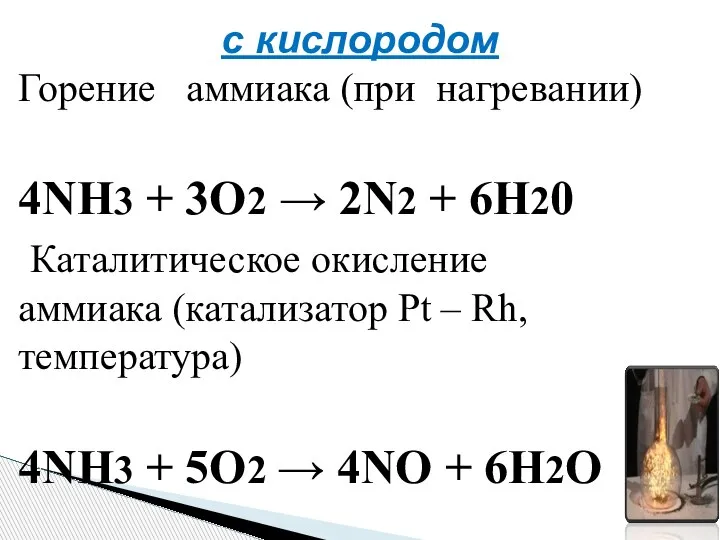


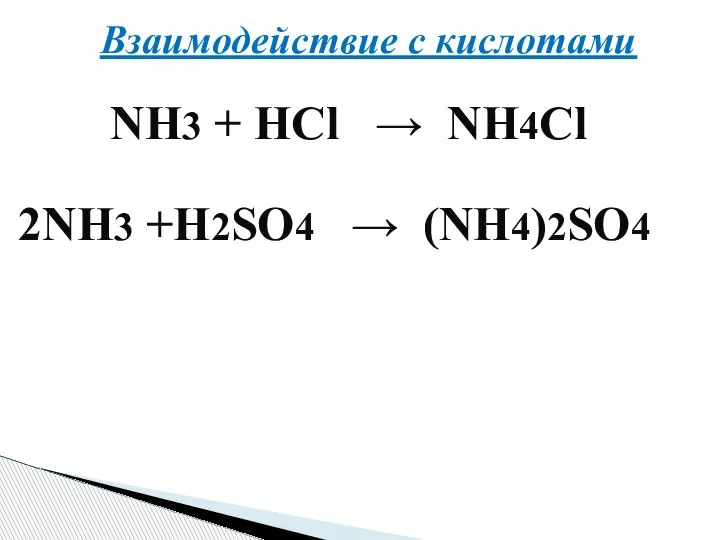





 Диаграмма состояния системы железо - углерод
Диаграмма состояния системы железо - углерод Лаки. Эмали. Красочные составы
Лаки. Эмали. Красочные составы Кислоты органические и неорганически
Кислоты органические и неорганически Химические реакции
Химические реакции Кремнийорганические мономеры: Органохлорсиланы
Кремнийорганические мономеры: Органохлорсиланы Алкены
Алкены Физические и химические свойства алкенов
Физические и химические свойства алкенов Простагландины. Воздействие фосфолипаз на фосфолипид
Простагландины. Воздействие фосфолипаз на фосфолипид Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Презентация на тему Нитраты и организм человека
Презентация на тему Нитраты и организм человека 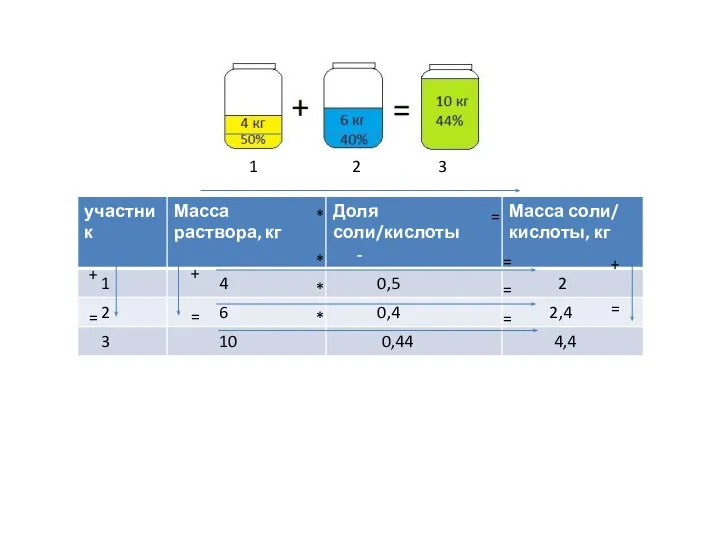 Концентрация растворов
Концентрация растворов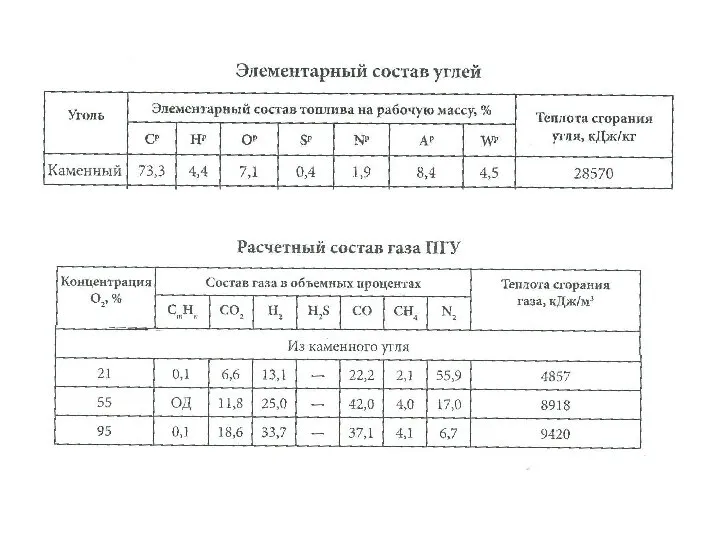 Элементарный состав углей
Элементарный состав углей Алканы: строение, номенклатура, изомерия, физические свойства
Алканы: строение, номенклатура, изомерия, физические свойства Презентация на тему Самородки 9 класс
Презентация на тему Самородки 9 класс  Отжиг сталей (отжиг 2-го рода) Лекция 2
Отжиг сталей (отжиг 2-го рода) Лекция 2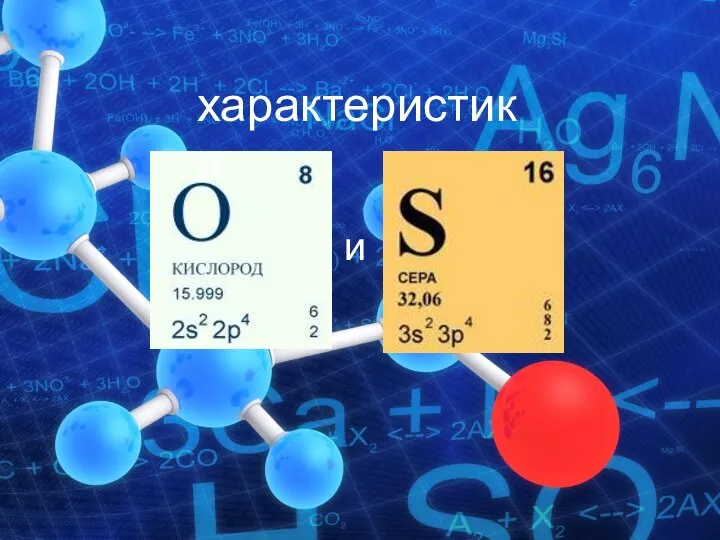 Характеристика кислорода и серы
Характеристика кислорода и серы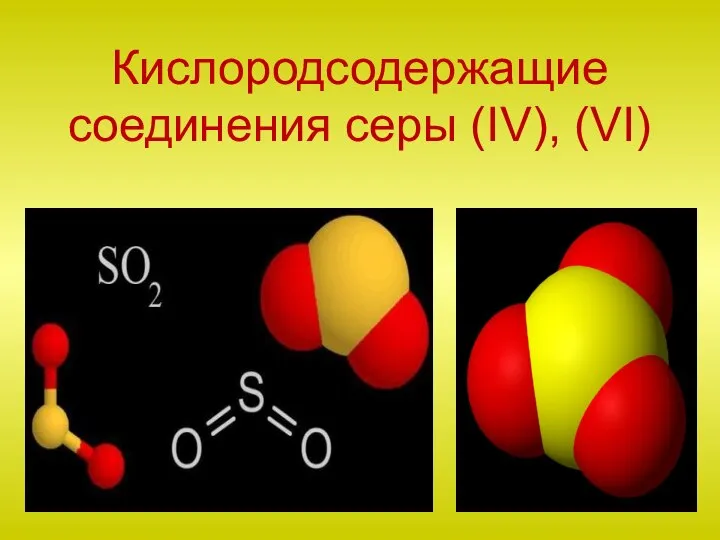 Кислородсодержащие соединения серы (IV), (VI)
Кислородсодержащие соединения серы (IV), (VI) Электролитическая диссоциация кислот
Электролитическая диссоциация кислот Учитель химии МАОУ СОШ № 61 города Тюмени Белова Н.В.
Учитель химии МАОУ СОШ № 61 города Тюмени Белова Н.В. Презентация в 8 классе к уроку по химии на тему__
Презентация в 8 классе к уроку по химии на тему__ Аморфные и кристаллические вещества
Аморфные и кристаллические вещества Радиоакивные металлы
Радиоакивные металлы Окислительно-восстановительные процессы
Окислительно-восстановительные процессы Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Презентация на тему Бензол
Презентация на тему Бензол  Основания
Основания Процесс диссоциации
Процесс диссоциации Алкины. Строение, изомерия, физические свойства, получение. Химические свойства, применение ацетилена
Алкины. Строение, изомерия, физические свойства, получение. Химические свойства, применение ацетилена