Содержание
- 2. Вопросы лекции: 3.Основные постулаты химической кинетики. 4.Последовательность и молекулярность реакции. 5. Типы реакции 1.Предмет химической кинетики,
- 4. Задачи химической кинетики Описание скоростных закономерностей химических процессов. Расшифровка механизма хим.процессов, включающего в себя как элементарные
- 5. Химическая кинетика изучает механизм и скорость химических превращений. Уравнения химической кинетики служат основой для расчетов технологических
- 6. Химическая кинетика рассматривает предмет своего исследования в диалектическом развитии процесса во времени и в пространстве.
- 7. Факторы влияющие на скорость реакции: Концентрация реагентов, Температура, Давление, Наличие катализатора, Инициаторы, Электромагнитное излучение, Электрический потенциал
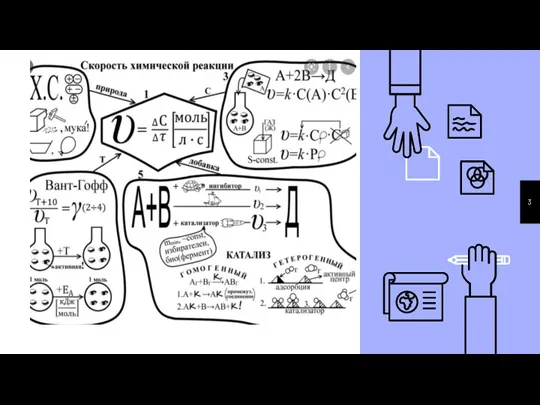
- 8. Скорость химической реакции есть изменение концентрации реагирующих веществ в единицу времени.
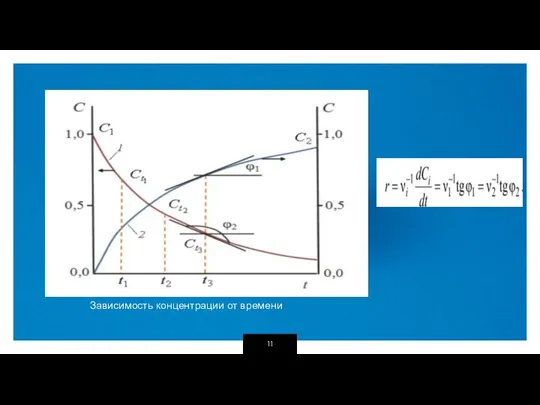
- 9. Графическое изображение зависимости концентрации реагентов от времени есть кинетическая кривая. Зависимость скорости реакции от концентрации реагирующих
- 10. Полное и краткое определение скорости реакции может быть через степень превращения Истинная скорость реакции определяется как
- 11. Зависимость концентрации от времени
- 12. r=k• [A]a •[B]b aA+bB=продукты
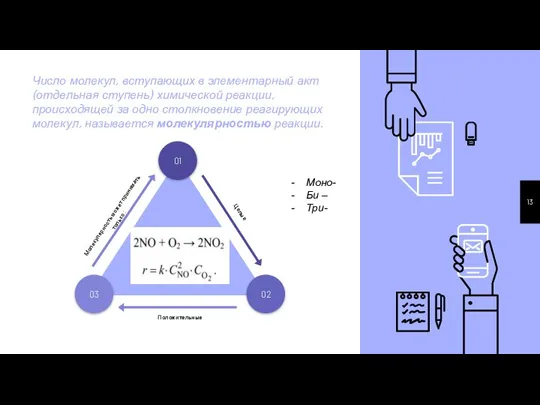
- 13. Число молекул, вступающих в элементарный акт (отдельная ступень) химической реакции, происходящей за одно столкновение реагирующих молекул,
- 14. Число столкновений молекул данного вещества А с молекулами других реагирующих веществ пропорционально концентрации молекул А, число
- 15. На самом деле в связи со стадийностью химических реакций, а также незначительной вероятности одновременного столкновения более
- 16. Основными параметрами химического процесса, влияющими на его скорость, являются концентрации реагирующих веществ и температура. Cкорость реакции
- 17. Типы реакции Простые Элементар-ные Сложные
- 18. Совокупность элементарных стадий, из которых складывается химическая реакция, называется ее механизмом. Различают детальный механизм химического процесса,
- 19. THANKS! Any questions?
- 20. Реакции нулевого порядка Скорость протекания химических реакций нулевого порядка не зависит от концентрации, т.е. она const.
- 21. Реакции первого порядка
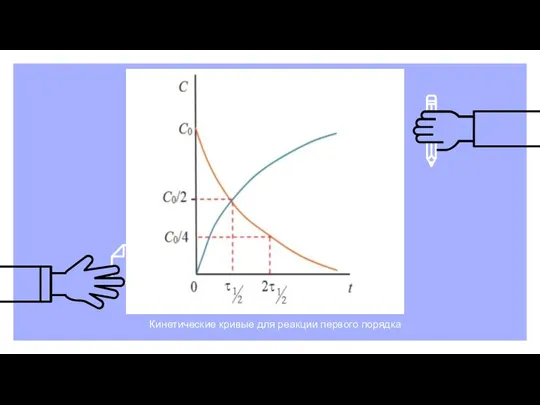
- 22. Кинетические кривые для реакции первого порядка
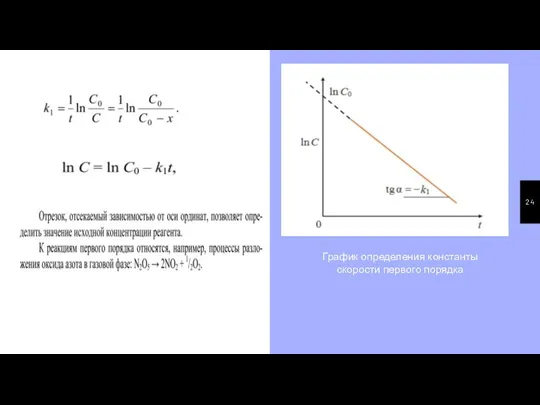
- 24. График определения константы скорости первого порядка
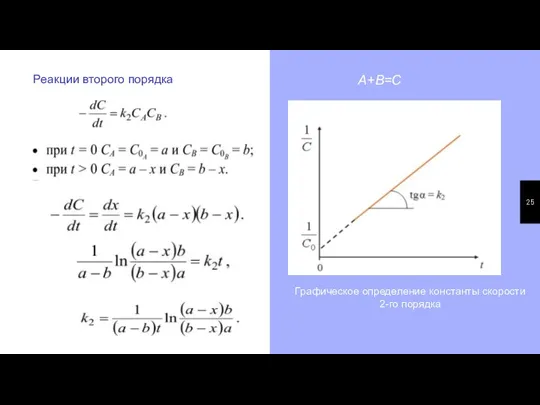
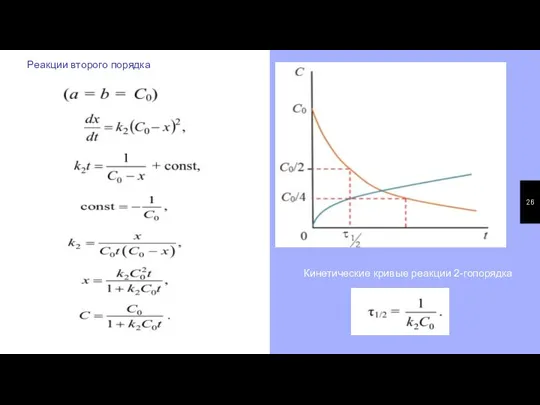
- 25. Реакции второго порядка А+В=С Графическое определение константы скорости 2-го порядка
- 26. Реакции второго порядка Кинетические кривые реакции 2-гопорядка
- 28. Скачать презентацию







![r=k• [A]a •[B]b aA+bB=продукты](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1168380/slide-11.jpg)








 Химическая связь
Химическая связь Разработка методики расчета фазового равновесия при длительном хранении СПГ
Разработка методики расчета фазового равновесия при длительном хранении СПГ Изомерия алкенов
Изомерия алкенов Галогены и их соединения
Галогены и их соединения Самородные минералы
Самородные минералы Периодический закон, 9 класс (1)
Периодический закон, 9 класс (1) Азотсодержащие органические соединения
Азотсодержащие органические соединения Цинк и его применение (11 класс)
Цинк и его применение (11 класс) Магматические горные породы
Магматические горные породы Химические реакции
Химические реакции Неметаллы. Агрегатные состояния неметаллов
Неметаллы. Агрегатные состояния неметаллов Электронная структура атомов
Электронная структура атомов Оксиды
Оксиды Классификация органических веществ
Классификация органических веществ Рений. Содержание рения в земной коре
Рений. Содержание рения в земной коре Нефть и способы её переработки
Нефть и способы её переработки Металлы. Химия. 11 класс
Металлы. Химия. 11 класс Сухая вода помогла измерить поляризацию ковалентных связей
Сухая вода помогла измерить поляризацию ковалентных связей Валентность
Валентность Химический состав клетки
Химический состав клетки Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д.И. Менделеева». «Химический дом и его обитат
Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д.И. Менделеева». «Химический дом и его обитат Типы химических реакций. Классификация химических реакций по числу и составу реагентов и продуктов ХР
Типы химических реакций. Классификация химических реакций по числу и составу реагентов и продуктов ХР Образование и получение веществ
Образование и получение веществ Обратимость химических реакций. Химическое равновесие
Обратимость химических реакций. Химическое равновесие Разминка
Разминка Алкины (ацетиленовые углеводороды)
Алкины (ацетиленовые углеводороды) Презентация на тему Природные источники углеводородов (9 класс)
Презентация на тему Природные источники углеводородов (9 класс) 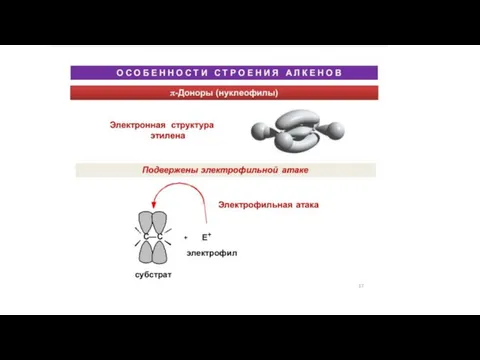 Особенности строения алкенов
Особенности строения алкенов