Содержание
- 2. Учение о химических процессах. Две части: Химическая термодинамика; Химическая кинетика. Химическая термодинамика – раздел химии о
- 3. Учение о химических процессах. Две части: Химическая термодинамика; Химическая кинетика. Химическая кинетика – раздел химии, в
- 4. Три основные части химической кинетики. Феноменологическая кинетика – описание зависимости скорости реакции веществ от концентраций, температуры
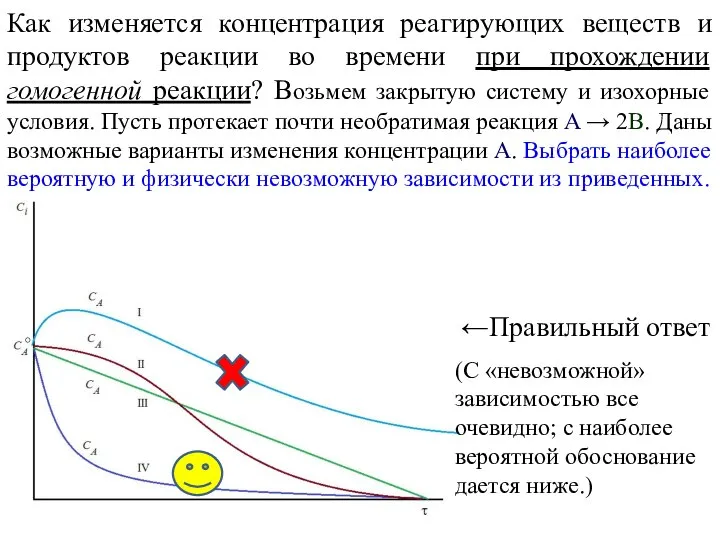
- 5. Как изменяется концентрация реагирующих веществ и продуктов реакции во времени при прохождении гомогенной реакции? Возьмем закрытую
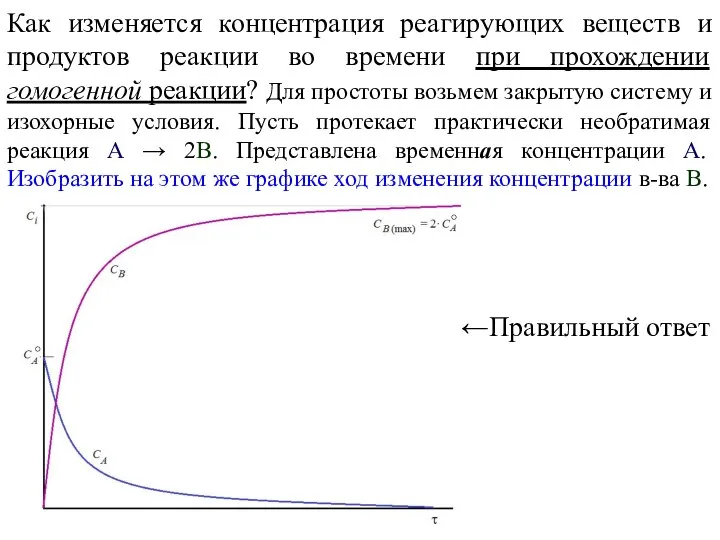
- 6. Как изменяется концентрация реагирующих веществ и продуктов реакции во времени при прохождении гомогенной реакции? Для простоты
- 7. А что же такое скорость реакции? Имеется гомогенная реакция A → νB (типа N2O4 →2NO2). Проследим,
- 8. От чего зависит скорость реакции? - помимо прочего − от концентраций исходных веществ (вещество здесь =
- 9. Ниже приведена рассчитанная по ур−ию (#) зависимость СA = f(τ) для мономолекулярной реакции для С°A =
- 10. Формулируем гипотезу: Если есть реакция ν1A + ν2B +…→… , то для неё v = k⋅CAν1
- 11. v = k⋅CAw1 ⋅CBw2⋅… (&) − это основное уравнение химической кинетики или уравнение Гульберга-Вааге или кинетический
- 13. Скачать презентацию








 Дефекты в кристаллах
Дефекты в кристаллах Теория химического строения органических веществ А.М. Бутлерова
Теория химического строения органических веществ А.М. Бутлерова Лекарственные средства – производные пиримидин 2,4,6-триона
Лекарственные средства – производные пиримидин 2,4,6-триона Химическая промышленность
Химическая промышленность Буферные системы
Буферные системы Nxf_uZGQ8YFvfhQYo-sHuA
Nxf_uZGQ8YFvfhQYo-sHuA Гидроксиды металлов
Гидроксиды металлов Гидрокрекинг нефтяного сырья
Гидрокрекинг нефтяного сырья Идеальная химическая лаборатория в школе
Идеальная химическая лаборатория в школе Спирты
Спирты Алкилирование. Алкилирующие агенты
Алкилирование. Алкилирующие агенты Теория электролитической диссоциации
Теория электролитической диссоциации Генетические ряды неорганических веществ
Генетические ряды неорганических веществ Текстуры руд
Текстуры руд тэд — без анимации(1)
тэд — без анимации(1) Презентация на тему Бром
Презентация на тему Бром  Химические уравнения. 8 класс
Химические уравнения. 8 класс Угольная кислота и ее соли
Угольная кислота и ее соли Алкены
Алкены Природный газ, состав применение в качестве топлива
Природный газ, состав применение в качестве топлива Кислоты
Кислоты Земная спираль Шанкуртуа
Земная спираль Шанкуртуа Качественные реакции на ионы металлов Работа выполнена учеником 9-го класса Бердинских Андреем
Качественные реакции на ионы металлов Работа выполнена учеником 9-го класса Бердинских Андреем Какую воду мы пьем
Какую воду мы пьем Стан електронів у атомі
Стан електронів у атомі Турнир знатоков химии
Турнир знатоков химии Белки
Белки Циклоалканы. Изомерия циклоалканов
Циклоалканы. Изомерия циклоалканов