Содержание
- 2. С открытием электрического тока многие химики XIX века начали экспериментировать это явление с теми или иными
- 3. В скором времени ученые сталкнулись, в тот момент еще непонятным, процессом: в разных экспирементах электропроводность воды
- 4. Svante August Arrhenius Теория Электролитической Диссоциации (1887 год)
- 5. Согласно ей все вещества делятся на: Электролиты Неэлектролиты
- 6. Основные положения ТЭД: Электролиты при растворении в воде распадаются (диссоциируют) на ионы – положительные и отрицательные.
- 7. По этой теории: Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода.
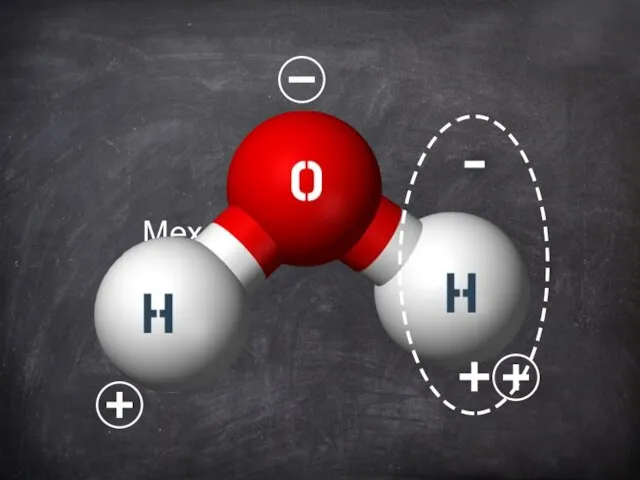
- 8. Механизм Диссоциации
- 14. Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах. Степень диссоциации
- 15. Слабые электролиты: почти все органические кислоты и вода; некоторые неорганические кислоты: HF, HClO, HClO2, HNO2, HCN,
- 16. Таким образом Электролитической диссоциацией называют процесс распада электролитов на ионы при растворении их в воде.
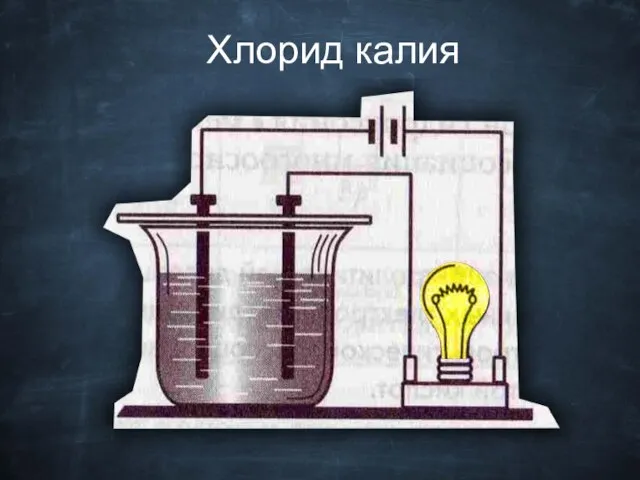
- 17. Хлорид калия
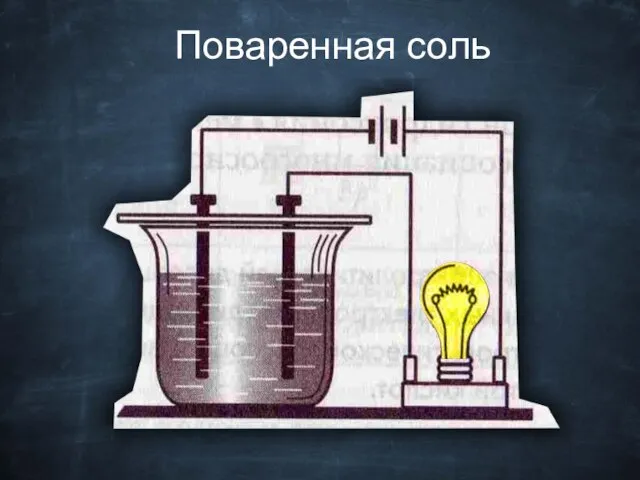
- 18. Поваренная соль
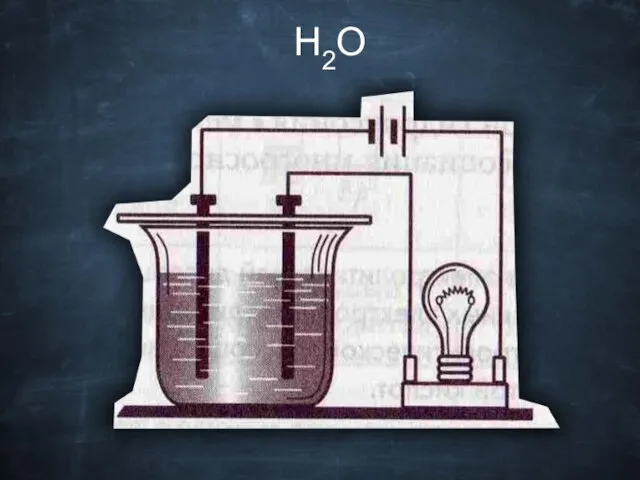
- 19. H2O
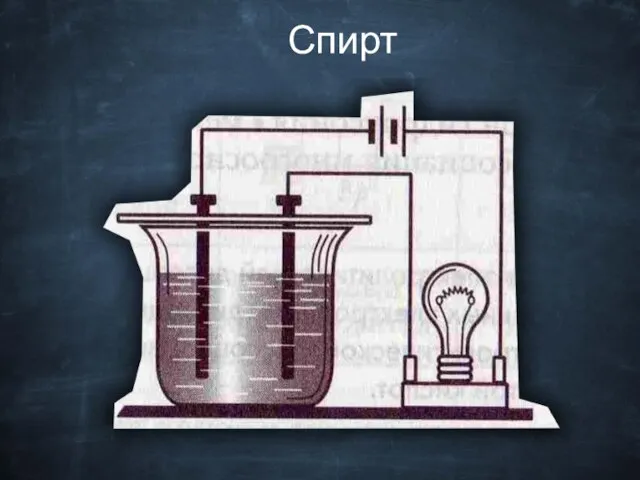
- 20. Спирт
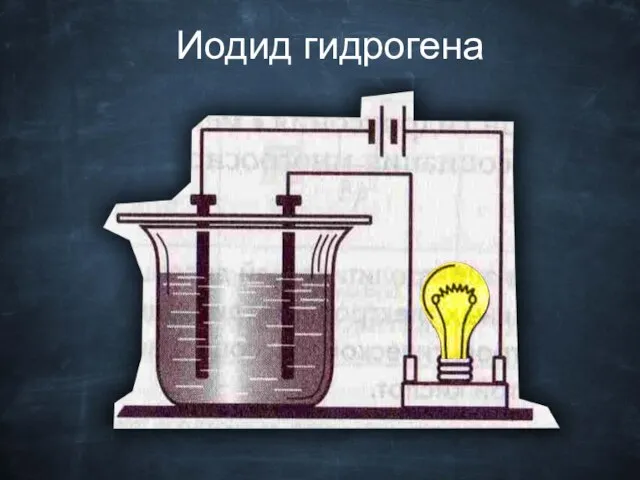
- 21. Иодид гидрогена
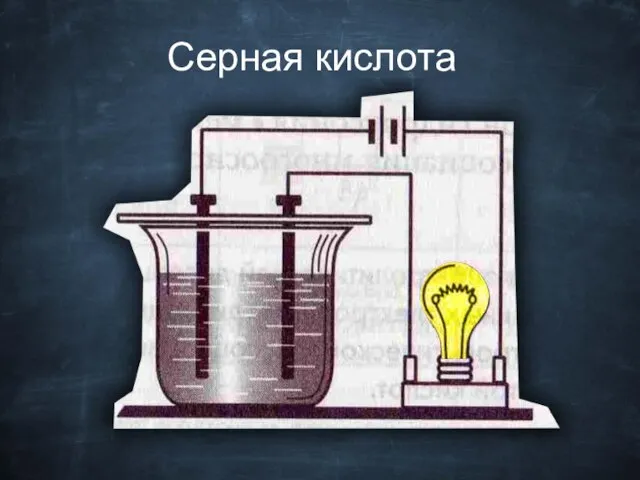
- 22. Серная кислота
- 23. Водный раствор АТФ
- 24. Оксид меди
- 25. Устойчивость комплексных соединений Комплексными соединениями называют сложные частицы образованные из более простых, которые находятся в узлах
- 26. При получении растворов комплексных соединений, происходит их диссоциация на ионы внутренней и внешней сферы. После отщепления
- 27. При смешивании двух растворов, содержащих ионы металла и лиганд, произойдет ступенчатое комплексообразование, т.е. последовательное присоединение лиганда
- 28. Присоединение лиганда к металлу будет происходить до тех пор, пока количество лигандов не станет равным координационному
- 29. Процесс диссоциации также можно охарактеризовать с помощью констант, называемых константами нестойкости комплексов: [MLn] ↔ MLn-1 +
- 30. Факторы, влияющие на устойчивость комплекса в растворах: Внешние факторы: температура, природа растворителя, ионная сила и состав
- 31. Процесс диссоциации также можно охарактеризовать с помощью констант, называемых константами нестойкости комплексов: [MLn] ↔ MLn-1 +
- 32. Спасибо за внимание! Научный руководитель: Токторбек кызы Дария
- 35. Скачать презентацию

























 Самостоятельные работы по разделу Химические реакции в рамках рабочей программы по химии для 8 класса
Самостоятельные работы по разделу Химические реакции в рамках рабочей программы по химии для 8 класса Щелочные металлы
Щелочные металлы Еще раз про электролиз…
Еще раз про электролиз… Химический опыт с горением борноэтилового эфира
Химический опыт с горением борноэтилового эфира Расчетная ячейка при МД моделировании. Граничные условия. Элементарная ячейка для атомов аргона
Расчетная ячейка при МД моделировании. Граничные условия. Элементарная ячейка для атомов аргона Синтез бензотиазин -S,S- диоксидов и тозилцинамонитрилов
Синтез бензотиазин -S,S- диоксидов и тозилцинамонитрилов Химический состав клетки
Химический состав клетки Вывод формул химических веществ
Вывод формул химических веществ Презентация на тему Синтетические моющие средства
Презентация на тему Синтетические моющие средства  MPKh_PREZENTATsIYa_2
MPKh_PREZENTATsIYa_2 Химические и физические явления
Химические и физические явления Первоначальные химические понятия. 2 раунд
Первоначальные химические понятия. 2 раунд Полезные ископаемые
Полезные ископаемые Алюминий. Свойства элементов подгруппы алюминия
Алюминий. Свойства элементов подгруппы алюминия Кислородные соединения азота, азотная кислота. Соли азотной кислоты. Удобрения
Кислородные соединения азота, азотная кислота. Соли азотной кислоты. Удобрения Химическая организация клетки
Химическая организация клетки Использование элементов модульной технологии на уроках химии
Использование элементов модульной технологии на уроках химии Презентация на тему Круговорот углерода в природе
Презентация на тему Круговорот углерода в природе  Чистые вещества и смеси
Чистые вещества и смеси Кинетика химических и биохимических процессов. Часть 1
Кинетика химических и биохимических процессов. Часть 1 Технические материалы. Металлические и неметаллические. (Тема 1)
Технические материалы. Металлические и неметаллические. (Тема 1) Жиры. Классификация
Жиры. Классификация ОГЭ №2, вопрос 1-16
ОГЭ №2, вопрос 1-16 Химические формулы. Относительная молекулярная масса. 8 класс
Химические формулы. Относительная молекулярная масса. 8 класс Типы химических реакций
Типы химических реакций Презентация на тему: Изомерия
Презентация на тему: Изомерия Дополнительный_материал_11.15_23.09.2022_e4f87550
Дополнительный_материал_11.15_23.09.2022_e4f87550 Схема монооксигеназной цепи микросом
Схема монооксигеназной цепи микросом