Содержание
- 2. Цели урока объяснять процесс производства серной кислоты; понимать процесс производства серной кислоты как равновесный и уметь
- 3. Ожидаемые результаты описывает основные стадии получения серной кислоты контактным способом и записывает уравнения реакций каждой стадий
- 4. Работа с терминами Слабая кислота Сильная кислота Обратимая реакция Химическое равновесие
- 5. Получение серной кислоты в промышленности https://bilimland.kz/ru/subject/ximiya/10-klass/proizvodstvo-sernoj-kisloty-kontaktnym-sposobom?mid=f2867163-9ee4-11e9-a361-1f1ed251dcfe
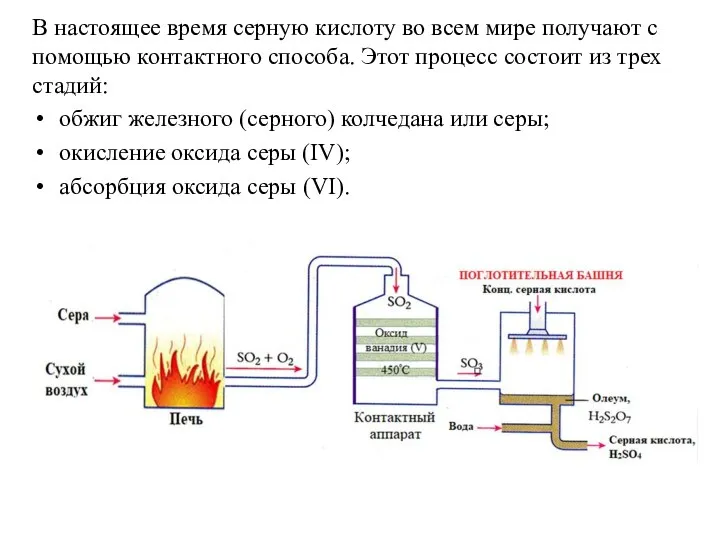
- 6. В настоящее время серную кислоту во всем мире получают с помощью контактного способа. Этот процесс состоит
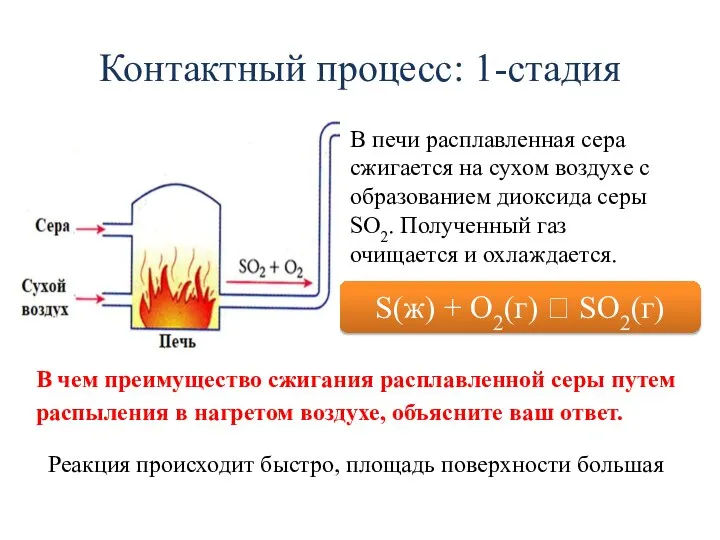
- 7. Контактный процесс: 1-стадия В печи расплавленная сера сжигается на сухом воздухе с образованием диоксида серы SO2.
- 8. Контактный процесс: 1-стадия В печи расплавленная сера сжигается на сухом воздухе с образованием диоксида серы SO2.
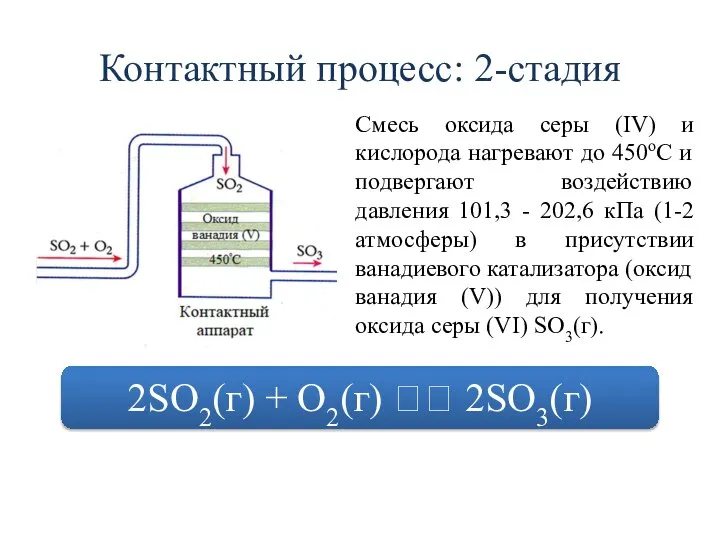
- 9. Контактный процесс: 2-стадия Смесь оксида серы (IV) и кислорода нагревают до 450oC и подвергают воздействию давления
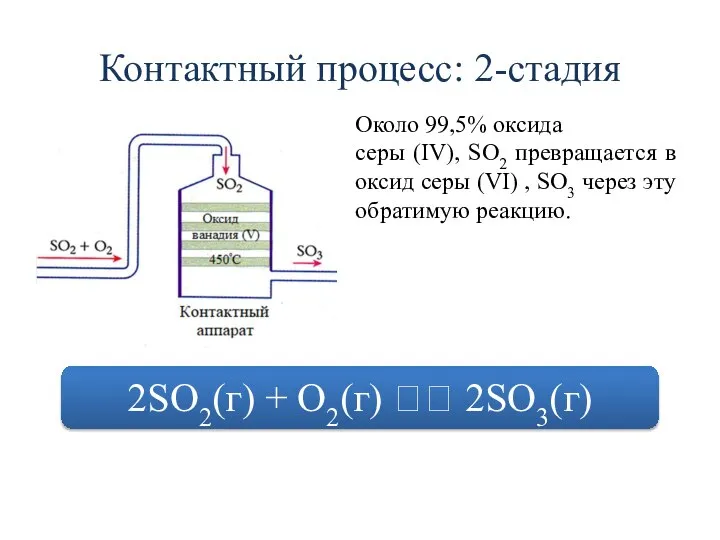
- 10. Контактный процесс: 2-стадия Около 99,5% оксида серы (IV), SO2 превращается в оксид серы (VI) , SO3
- 11. II стадия. Окисление оксида серы (IV) до оксида серы (VI) Диоксид серы + кислород (из воздуха)
- 12. II стадия. Окисление оксида серы (IV) до оксида серы (VI) Диоксид серы + кислород (из воздуха)
- 13. II стадия. Окисление оксида серы (IV) до оксида серы (VI) Диоксид серы + кислород (из воздуха)
- 14. II стадия. Окисление оксида серы (IV) до оксида серы (VI) Диоксид серы + кислород (из воздуха)
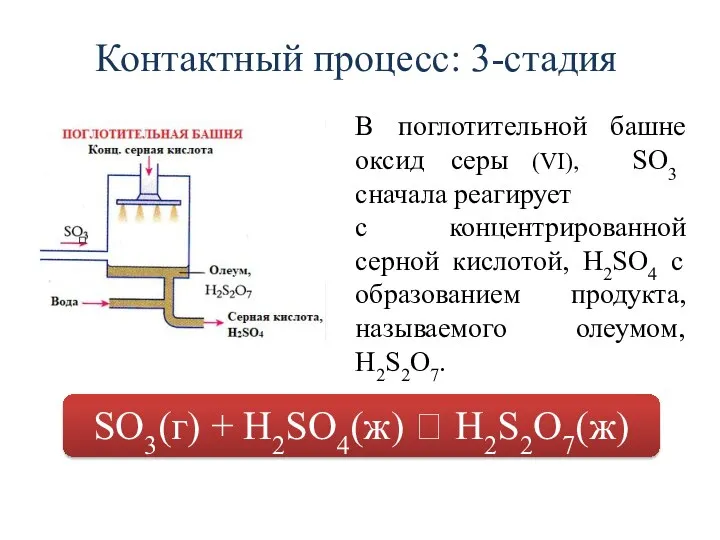
- 15. Контактный процесс: 3-стадия В поглотительной башне оксид серы (VI), SO3 сначала реагирует с концентрированной серной кислотой,
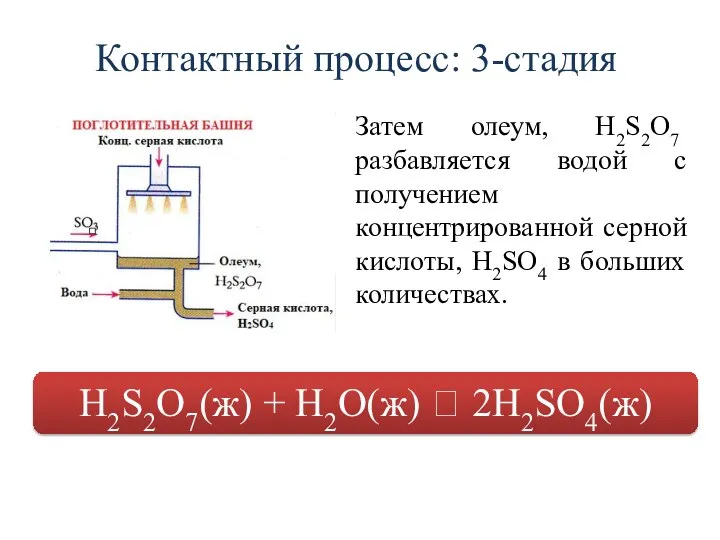
- 16. Контактный процесс: 3-стадия Затем олеум, H2S2O7 разбавляется водой с получением концентрированной серной кислоты, H2SO4 в больших
- 17. IIІ стадия. Получение серной кислоты из оксида серы (VI) Почему для поглощения оксида серы (VI) используется
- 18. Критерий оценивания: описывает основные стадии получения серной кислоты контактным способом и записывает уравнения реакций каждой стадий
- 19. Критерий оценивания: описывает основные стадии получения серной кислоты контактным способом и записывает уравнения реакций каждой стадий
- 20. Критерий оценивания: описывает основные стадии получения серной кислоты контактным способом и записывает уравнения реакций каждой стадий
- 22. Скачать презентацию













 Альдегиды, гомология, изомерия, номенклатура
Альдегиды, гомология, изомерия, номенклатура Обобщение и повторение за курс основной школы по химии. 9 класс
Обобщение и повторение за курс основной школы по химии. 9 класс Арены. Электронное строение молекулы бензола. Гомологический ряд аренов, номенклатура, изомерия
Арены. Электронное строение молекулы бензола. Гомологический ряд аренов, номенклатура, изомерия 1_
1_ Алканы. Циклоалканы
Алканы. Циклоалканы Галогены и их соединения
Галогены и их соединения Расчеты по химическим уравнениям реакций
Расчеты по химическим уравнениям реакций Кислоты. Кислоты в животном мире
Кислоты. Кислоты в животном мире Коллоидные системы
Коллоидные системы Биохимия статическая, динамическая, функциональная
Биохимия статическая, динамическая, функциональная Презентация на тему Основные законы науки химии
Презентация на тему Основные законы науки химии  Основания. Классификация, состав и номенклатура оснований
Основания. Классификация, состав и номенклатура оснований Презентация на тему Нефть. Переработка нефти
Презентация на тему Нефть. Переработка нефти  Альдегиды и кетоны (часть 2)
Альдегиды и кетоны (часть 2) Строение органических молекул. (Лекция 2)
Строение органических молекул. (Лекция 2) Презентация на тему Гормоны
Презентация на тему Гормоны  Ovr-1
Ovr-1 Химические и физические свойства воды
Химические и физические свойства воды Алканы 10-класс
Алканы 10-класс Презентация на тему Химические свойства металлов
Презентация на тему Химические свойства металлов  Металлом называется светлое тело, которое ковать можно
Металлом называется светлое тело, которое ковать можно Конденсированные гетероциклы. Нуклеотиды. Нуклеиновые кислоты
Конденсированные гетероциклы. Нуклеотиды. Нуклеиновые кислоты Алкины. Пропин
Алкины. Пропин Применение алкенов
Применение алкенов Презентация на тему Кислород О2
Презентация на тему Кислород О2  Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д.И. Менделеева». «Химический дом и его обитат
Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д.И. Менделеева». «Химический дом и его обитат Криптон. Самостоятельная работа
Криптон. Самостоятельная работа Презентация на тему Классификация химических реакций (11 класс)
Презентация на тему Классификация химических реакций (11 класс)