Содержание
- 2. IV A – группа подгруппа углерода: С, Si, Ge, Sn, Pb ns2np2
- 3. Высшая с.о. +4, низшая с.о. -4 На внешнем уровне 4е, ns2np2 Высший оксид RO2 Летучее водородное
- 4. Углерод Происхождение названия Международное название происходит от латинского carbo — уголь, связанного с древним корнем kar
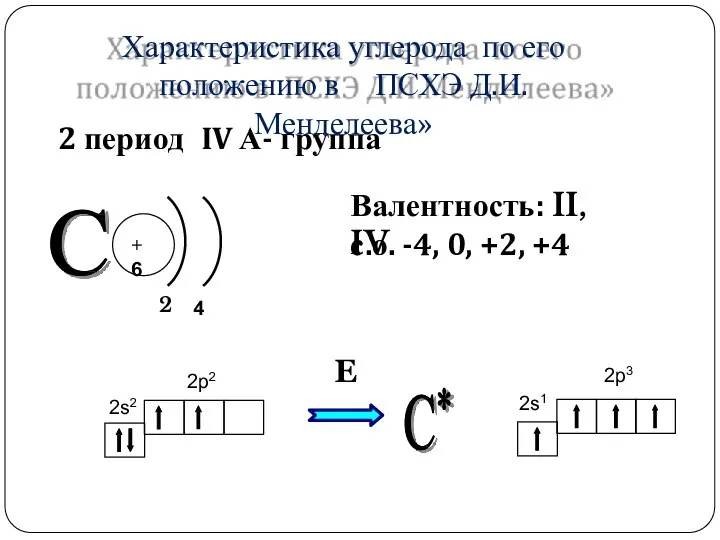
- 5. +6 2 4 2s2 2p2 Характеристика углерода по его положению в ПСХЭ Д.И.Менделеева» Е 2s1 2p3
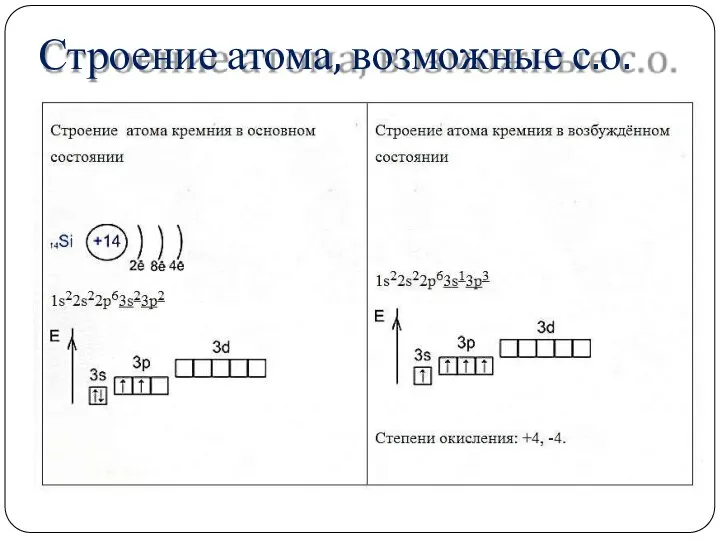
- 6. Строение атома, возможные с.о.
- 7. Распространение углерода в природе
- 8. Распространение кремния в природе Второй по распространённости элемент в земной коре после кислорода (27,6% по массе).
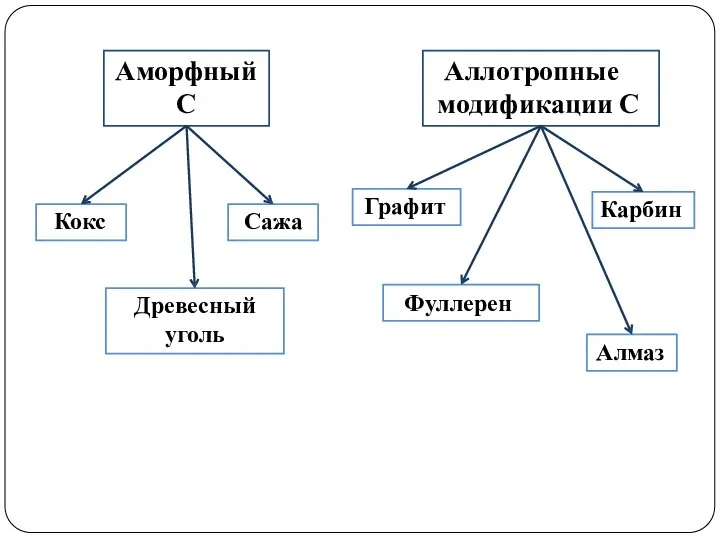
- 9. Графит Аморфный С Аллотропные модификации С Древесный уголь Сажа Кокс Фуллерен Карбин Алмаз
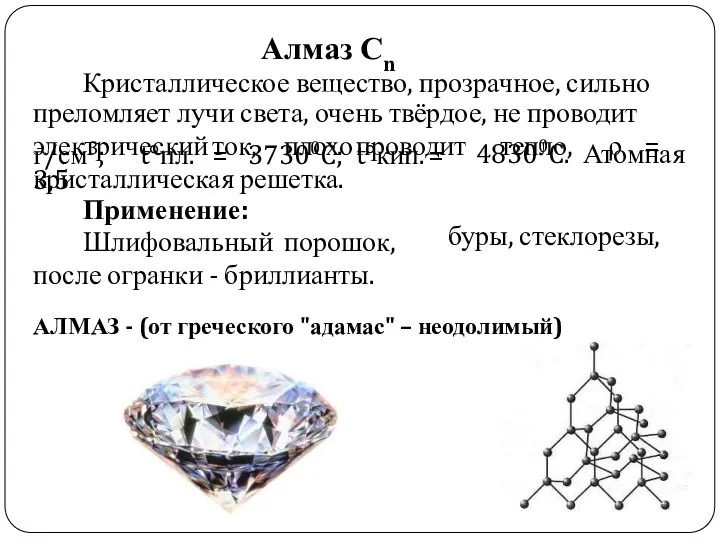
- 10. Кристаллическое вещество, прозрачное, сильно преломляет лучи света, очень твёрдое, не проводит электрический ток, плохо проводит тепло,
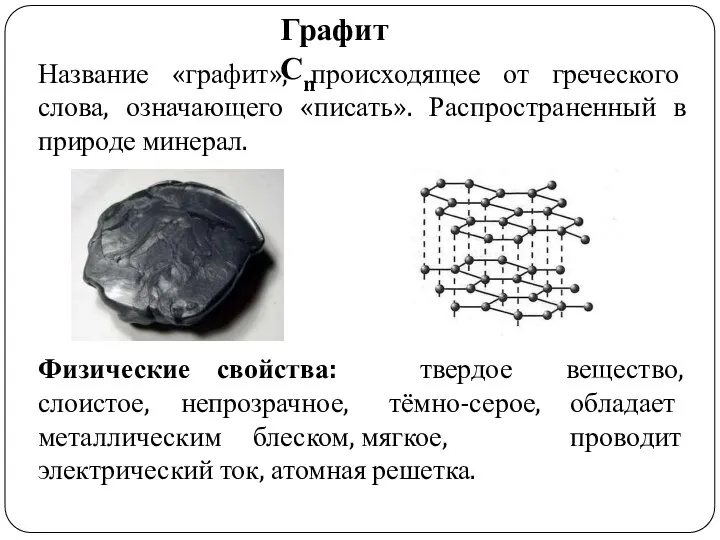
- 11. Графит Сn Название «графит», происходящее от греческого слова, означающего «писать». Распространенный в природе минерал. Физические свойства:
- 12. Графитовый порошок – изготовление минеральных красок. Смазочный материал (в смеси с маслом). Графитовые стержни – электроды
- 13. Карбин Белые кристаллы Состоит из цепей, образованных участками: -С≡С-С≡С- (карбин) или =С=С=С=С= (поликумулен). Получен искусственным путем.
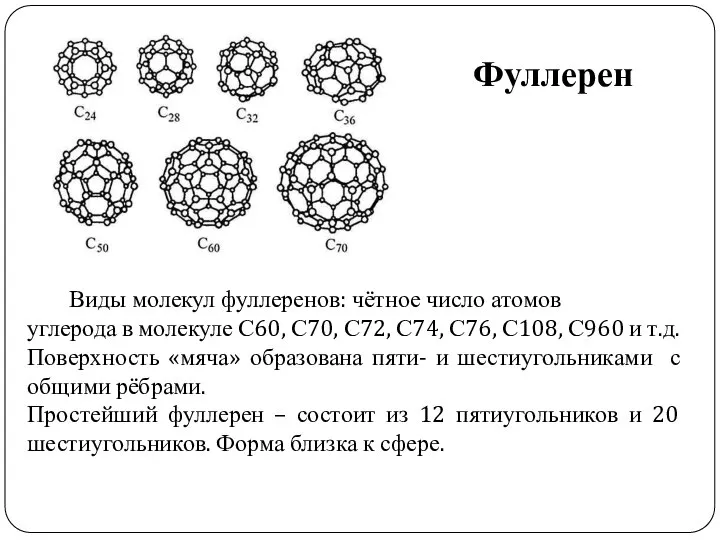
- 14. Фуллерен Виды молекул фуллеренов: чётное число атомов углерода в молекуле С60, С70, С72, С74, С76, С108,
- 15. Фуллерен Кристаллические вещества чёрного цвета с металлическим блеском. Полупроводники. При высоком давлении и комнатной температуре легко
- 16. Древесный уголь Образуется при разложении древесины без доступа воздуха. Адсорбция – процесс поглощения газов и растворенных
- 17. Аллотропия кремния вещество с Тёмно-серое металлическим блеском, большая твёрдость, хрупок, полупроводник; t°пл =1400°C. Структура подобна алмазу.
- 18. ? Химические свойства углерода Восстановительные свойства (с.о.+2, +4) С кислородом: C + O2 CO2 При недостатке
- 19. Л.о.№10. Восстановительные свойства водорода и углерода. Цель: изучить восстановительные свойства водорода и углерода. Ход опыта: ?
- 20. 1. Восстановительные свойства (с.о.+2, +4) 2. С оксидами: 0 ? C + 2CuO = 2Cu +
- 22. Скачать презентацию













 Электролитическая диссоциация
Электролитическая диссоциация Присадки для базовых масел. Присадки и наполнители пластичных смазок
Присадки для базовых масел. Присадки и наполнители пластичных смазок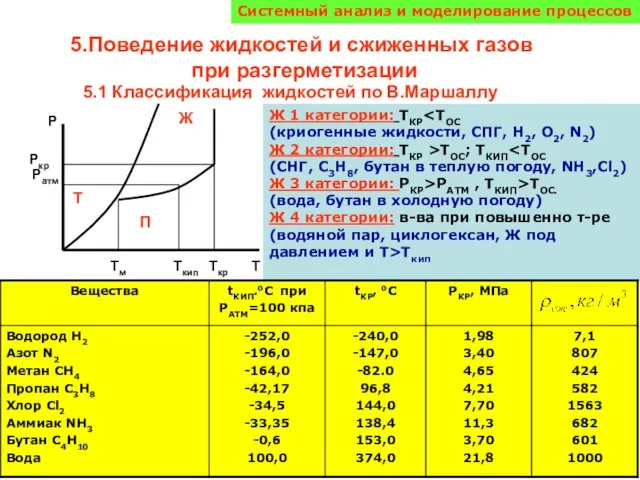 Поведение жидкостей и сжиженных газов при разгерметизации
Поведение жидкостей и сжиженных газов при разгерметизации Введение в метаболизм
Введение в метаболизм Строение атома. Химия, 8 класс
Строение атома. Химия, 8 класс Строение атома
Строение атома Нефть. Черное золото или черная смерть
Нефть. Черное золото или черная смерть Оксиды и гидроксиды
Оксиды и гидроксиды Вебинар. Гидролиз солей
Вебинар. Гидролиз солей Общие способы получения металлов
Общие способы получения металлов Металлы 9 класс
Металлы 9 класс Расчет равновесного состояния системы натрий-кислород-водород, для энергетических ядерных реакторов
Расчет равновесного состояния системы натрий-кислород-водород, для энергетических ядерных реакторов Пиримидин (шестичленный гетероцикл с двумя атомами азота)
Пиримидин (шестичленный гетероцикл с двумя атомами азота) Открытый урок химии. Типы химических реакций
Открытый урок химии. Типы химических реакций Приключение кислорода
Приключение кислорода Презентация на тему Каучуки
Презентация на тему Каучуки  получение Ме презентация
получение Ме презентация Своя игра по химии
Своя игра по химии Какую воду мы пьем
Какую воду мы пьем Цикл Кребса
Цикл Кребса Экстракционное разделение радионуклидов
Экстракционное разделение радионуклидов Применение обратимых и необратимых реакций в быту
Применение обратимых и необратимых реакций в быту Кислоты. состав, номенклатура и их их классификация
Кислоты. состав, номенклатура и их их классификация Коррозия металлов
Коррозия металлов Моделирование деформаций углеродных слоёв при функционализации технического углерода
Моделирование деформаций углеродных слоёв при функционализации технического углерода Презентация на тему Экологические риски при добыче и переработке нефти
Презентация на тему Экологические риски при добыче и переработке нефти  Кислоты. Кислоты, вокруг нас
Кислоты. Кислоты, вокруг нас Химия 11 класс
Химия 11 класс