3H2O
ZnO + H2SO4 = ZnSO4 + H2O
Амфотерный оксид + щелочь = соль (+ вода)
ZnO + 2KOH = K2ZnO2 + H2O (Правильнее: ZnO + 2KOH + H2O = K2[Zn(OH)4])
Al2O3 + 2NaOH = 2NaAlO2 + H2O (Правильнее: Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4])
Амфотерный оксид + кислотный оксид = соль
ZnO + CO2 = ZnCO3
Амфотерный оксид + основный оксид = соль (при сплавлении)
ZnO + Na2O = Na2ZnO2
Al2O3 + K2O = 2KAlO2
Cr2O3 + CaO = Ca(CrO2)2
Соли
Соль слабой кислоты + сильная кислота = соль сильной кислоты + слабая кислота
Na2SiO3 + 2HNO3 = 2NaNO3 + H2SiO3
Растворимая соль + растворимая соль = нерастворимая соль + соль
Pb(NO3)2 + K2S = PbS + 2KNO3
СaCl2 + Na2CO3 = CaCO3 + 2NaCl
Растворимая соль + щелочь = соль + нерастворимое основание
Cu(NO3)2 + 2NaOH = 2NaNO3 + Cu(OH)2
2FeCl3 + 3Ba(OH)2 = 3BaCl2 + 2Fe(OH)3
Растворимая соль металла (*) + металл (**) = соль металла (**) + металл (*)
Zn + CuSO4 = ZnSO4 + Cu
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Важно: 1) металл (**) должен находиться в ряду напряжений
левее металла (*), 2) металл (**) НЕ должен реагировать с водой.











 Plexiglas. Органическое стекло
Plexiglas. Органическое стекло Без золота прожить можно, без соли нельзя
Без золота прожить можно, без соли нельзя Основы химической кинетики
Основы химической кинетики Флэшмоб: Лаборатория на кухне
Флэшмоб: Лаборатория на кухне Алкены. Роль алкенов в жизни человека
Алкены. Роль алкенов в жизни человека Водородные соединения неметаллов
Водородные соединения неметаллов Химиялық қоспалар
Химиялық қоспалар Терпеноиды. Эфирные масла
Терпеноиды. Эфирные масла Нітрогеновмісні сполуки
Нітрогеновмісні сполуки Основные законы и понятия химии. Основные классы неорганических соединений. Химический эквивалент. Закон эквивалентов
Основные законы и понятия химии. Основные классы неорганических соединений. Химический эквивалент. Закон эквивалентов Арены. Электронное строение молекулы бензола. Гомологический ряд аренов, номенклатура, изомерия
Арены. Электронное строение молекулы бензола. Гомологический ряд аренов, номенклатура, изомерия Оксиды азота
Оксиды азота Гибридизация
Гибридизация Презентация на тему Классификация углеводов
Презентация на тему Классификация углеводов  Ионные двигатели
Ионные двигатели План выполнения домашней работы по теме Алкадиены
План выполнения домашней работы по теме Алкадиены Презентация на тему Полимеры
Презентация на тему Полимеры  Азот. Аммиак. Соли аммония (1)
Азот. Аммиак. Соли аммония (1) Изучение микроклимата коровника с целью создания системы очистки воздуха от аммиака
Изучение микроклимата коровника с целью создания системы очистки воздуха от аммиака Алканы: строение, номенклатура, изомерия, физические свойства
Алканы: строение, номенклатура, изомерия, физические свойства Соединения алифатического ряда
Соединения алифатического ряда Нуклеинови киселини
Нуклеинови киселини Применение личностно-ориентированного подхода в обучении химии
Применение личностно-ориентированного подхода в обучении химии 20141013_dragotsennye_kamni_yuzhnogo_urala
20141013_dragotsennye_kamni_yuzhnogo_urala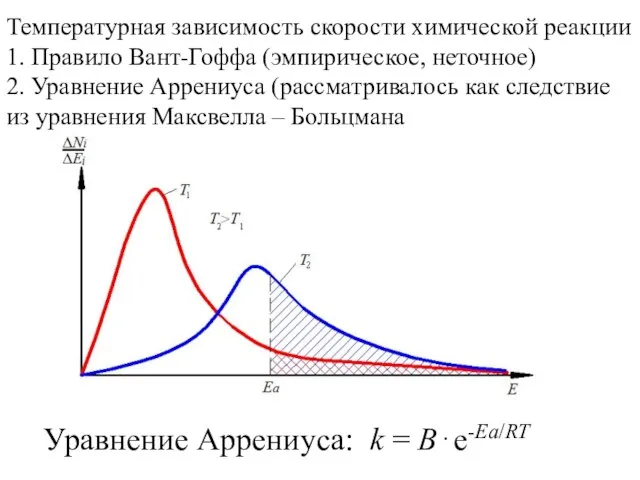 Температурная зависимость скорости химической реакции
Температурная зависимость скорости химической реакции Выращивание кристаллов медного купороса с использованием воды различной степени очистки
Выращивание кристаллов медного купороса с использованием воды различной степени очистки Коррозия металлов
Коррозия металлов Комплексонометрическое титрование. 5 лекция. Часть 2
Комплексонометрическое титрование. 5 лекция. Часть 2