Содержание
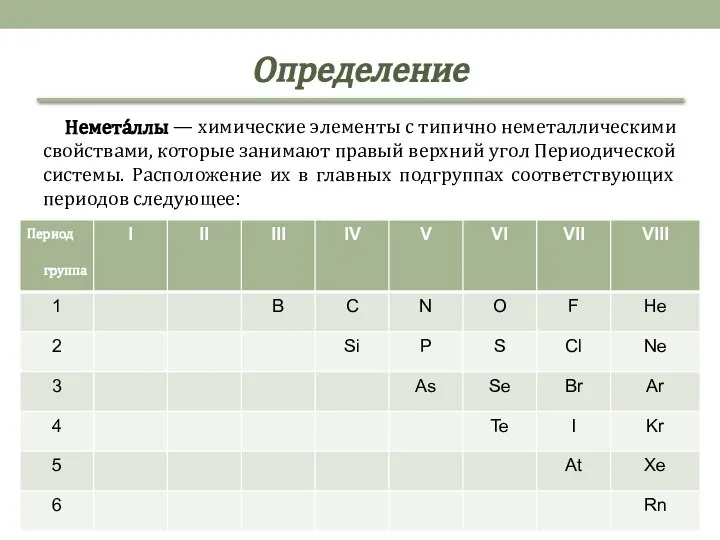
- 2. Определение Немета́ллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы.
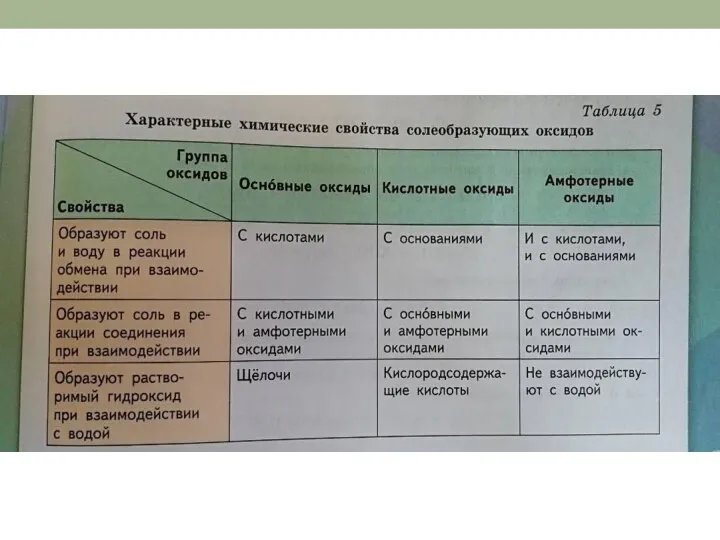
- 3. Химические свойства Для атомов неметаллов, а следовательно, и для образованных ими простых веществ характерны как окислительные,
- 4. Окислительные свойства сульфид натрия хлорид железа(III) нитрид магния
- 5. Окислительные свойства сероводород хлороводород аммиак t◦ свет p,t◦, катал.
- 6. Окислительные свойства H, Si, As, P, Se, C, S, I, Br, Cl, N, O, F Усиление
- 7. Окислительные свойства
- 8. Окислительные свойства
- 9. Окислительные свойства свет
- 10. Восстановительные свойства t◦ t◦ несолеобразующий оксид солеобразующий кислотный оксид
- 11. Восстановительные свойства t◦ t◦
- 12. Восстановительные свойства
- 13. ВЗАИМОДЕЙСТВИЕ С КИСЛОТАМИ Концентрированная серная кислота очень активно взаимодействует с неметаллами, окисляя их до высшей степени
- 14. Азотная кислота как сильный окислитель окисляет неметаллы до соответствующих кислот. Концентрированная (более 60%) азотная кислота восстанавливается
- 15. Химические свойства
- 16. Химические свойства Чем левее стоит металл в этом ряду, тем более сильным восстановителем он является. Каждый
- 17. Металлы, являющиеся самыми сильными восстановителями (щелочные и щелочноземельные), в любых водных растворах взаимодействуют прежде всего с
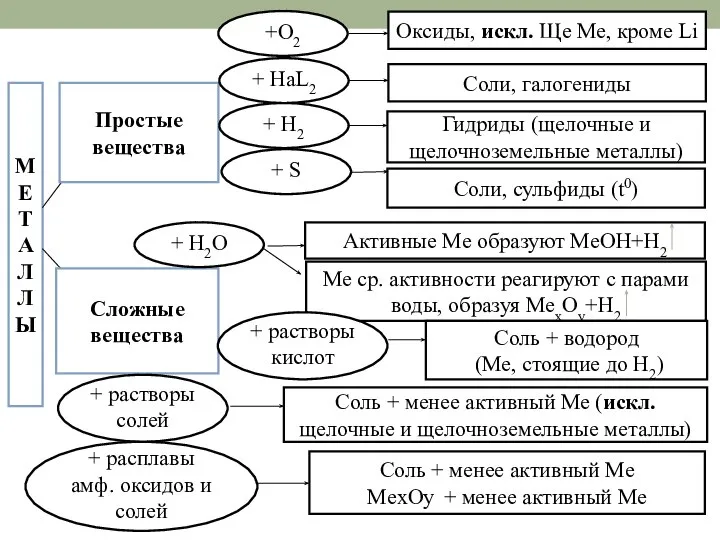
- 18. МЕ Т А Л Л Ы Простые вещества Сложные вещества + HaL2 Оксиды, искл. Ще Ме,
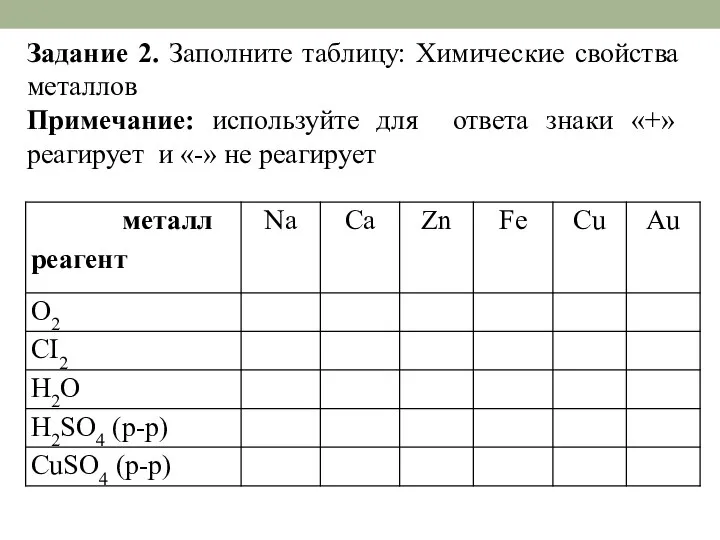
- 19. Задание 2. Заполните таблицу: Химические свойства металлов Примечание: используйте для ответа знаки «+» реагирует и «-»
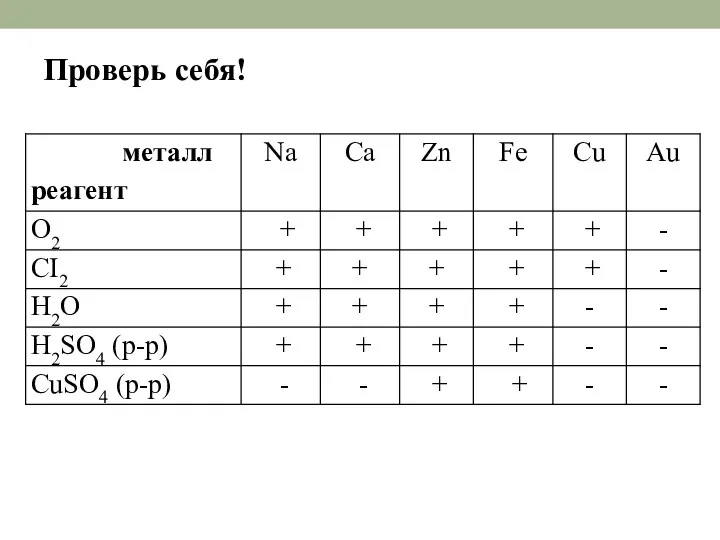
- 20. Проверь себя!
- 21. Взаимодействие металлов с кислородом пероксид натрия оксид натрия (основный оксид) оксид лития оксид кальция t◦ t◦
- 22. Взаимодействие металлов с неметаллами хлорид магния хлорид железа (III) гидрид кальция t◦
- 23. Взаимодействие металлов с неметаллами нитрид лития сульфид железа (II) t◦
- 24. Взаимодействие металлов со сложными веществами гидроксид натрия гидроксид бария гидроксид алюминия
- 25. Взаимодействие металлов со сложными веществами гидроксид магния t◦ H2O, пар железная окалина
- 26. Взаимодействие металлов со сложными веществами
- 27. С солями менее активных металлов в растворе. В результате такой реакции образуется соль более активного металла
- 31. Скачать презентацию























 Презентация на тему Чистые вещества и смеси. Химический диктант
Презентация на тему Чистые вещества и смеси. Химический диктант  1-методы количественного анализа
1-методы количественного анализа Звездный час. Знатоки химии
Звездный час. Знатоки химии Внеклассное мероприятие по химии. Своя игра
Внеклассное мероприятие по химии. Своя игра Цианоакрилатовая камера для выявления жировых следов
Цианоакрилатовая камера для выявления жировых следов Презентация на тему Кислород О2
Презентация на тему Кислород О2  Положение металлов в периодической системе Д.И. Менделеева. Физические свойства металлов
Положение металлов в периодической системе Д.И. Менделеева. Физические свойства металлов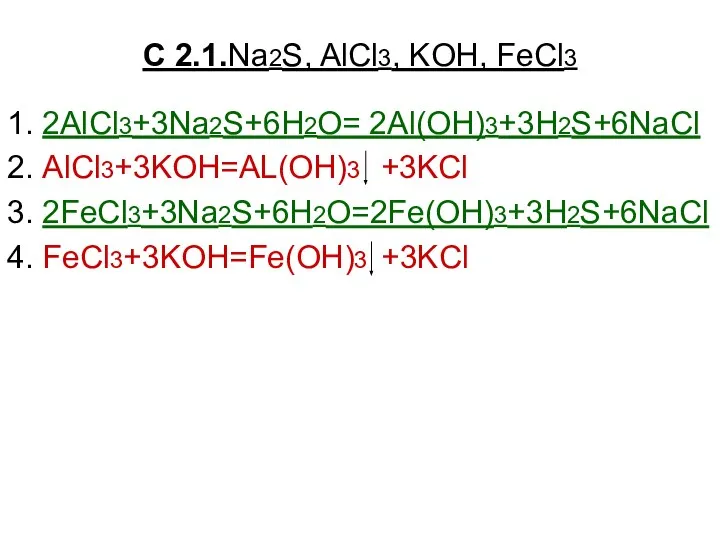 Na2S, AlCl3, KOH, FeCl3
Na2S, AlCl3, KOH, FeCl3 Презентация на тему Теория электролитической диссоциации обобщающий урок
Презентация на тему Теория электролитической диссоциации обобщающий урок  Получение галогенов. Биологическое значение и применение галогенов и их соединений. (1)
Получение галогенов. Биологическое значение и применение галогенов и их соединений. (1) Prezentatsia1 (1)
Prezentatsia1 (1) Алмазы
Алмазы Кинетика кристаллизации сплавов
Кинетика кристаллизации сплавов Химический состав клетки
Химический состав клетки 1_Лекція Комплексн
1_Лекція Комплексн Презентация на тему Химический элемент - водород
Презентация на тему Химический элемент - водород  Применение алкенов
Применение алкенов Согласованное и несогласованное действие заместителей в бензольном кольце
Согласованное и несогласованное действие заместителей в бензольном кольце СТЕПЕНЬ ОКИСЛЕНИЯ
СТЕПЕНЬ ОКИСЛЕНИЯ Серная кислота и ее соли
Серная кислота и ее соли Кинетика химических и биохимических процессов. Часть 1
Кинетика химических и биохимических процессов. Часть 1 знаки химических элементов,относительная атомная масса
знаки химических элементов,относительная атомная масса Исследование концентрированных заквасок для сметаны
Исследование концентрированных заквасок для сметаны Алмаз Подготовила: УЧЕНИЦА 9 «А» КЛАССА КАЗИЕВА МАРЖАН
Алмаз Подготовила: УЧЕНИЦА 9 «А» КЛАССА КАЗИЕВА МАРЖАН Stroenie_atoma__1
Stroenie_atoma__1 Фосфор – химический элемент
Фосфор – химический элемент Биосенсоры. Основные принципы (лекция 2)
Биосенсоры. Основные принципы (лекция 2) Химические реакции разложения и соединения
Химические реакции разложения и соединения