Содержание
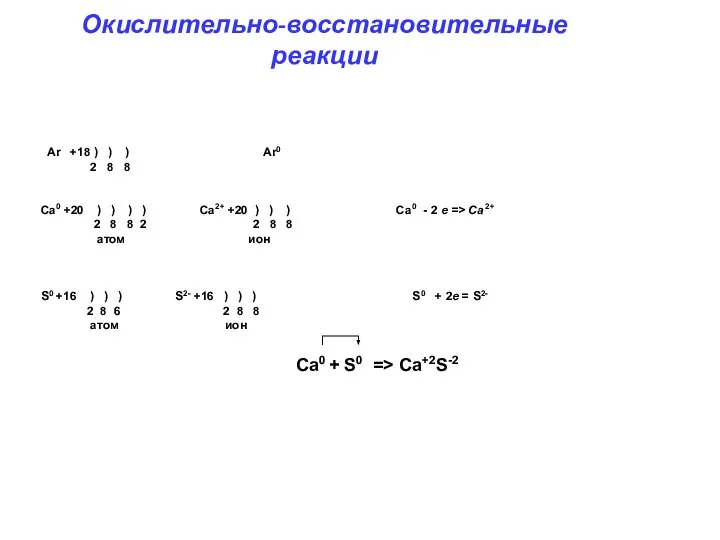
- 2. Ar +18 ) ) ) Ar0 2 8 8 Ca0 +20 ) ) ) ) Ca2+
- 3. Расставьте степени окисления элементов в реакциях. Сравните, как ведут себя степени окисления в процессе реакции. HCl
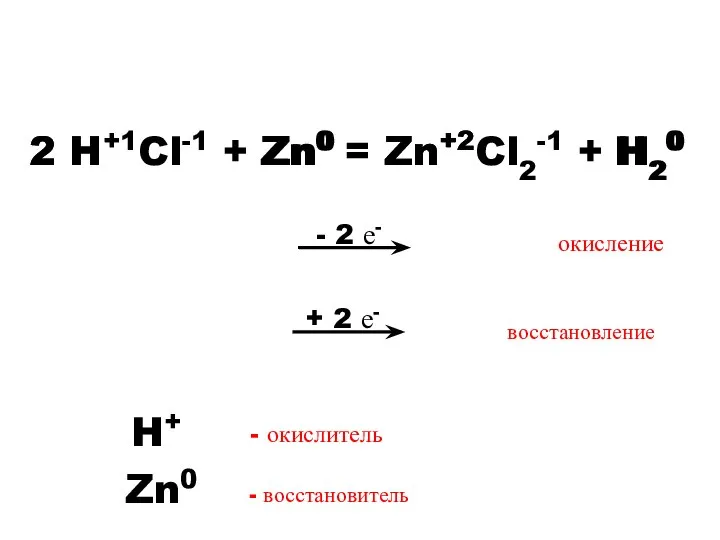
- 4. - 2 е- 2 H+1Cl-1 + Zn0 = Zn+2Cl2-1 + H20 Zn0 2 H+ Zn+2 H20
- 5. Окисление – процесс отдачи электронов. Восстановление – процесс присоединения электронов. Окислитель – элемент, принимающий электроны. Восстановитель
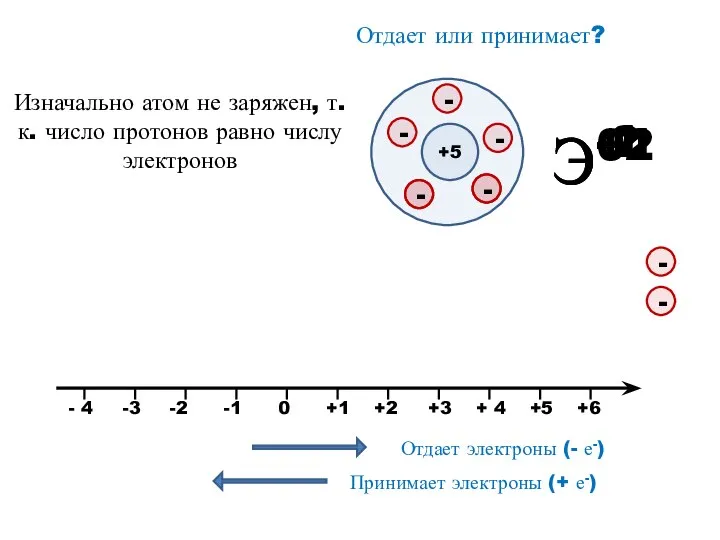
- 6. Э+1 Э+2 Э-2 Э-1 Отдает или принимает? +5 Изначально атом не заряжен, т.к. число протонов равно
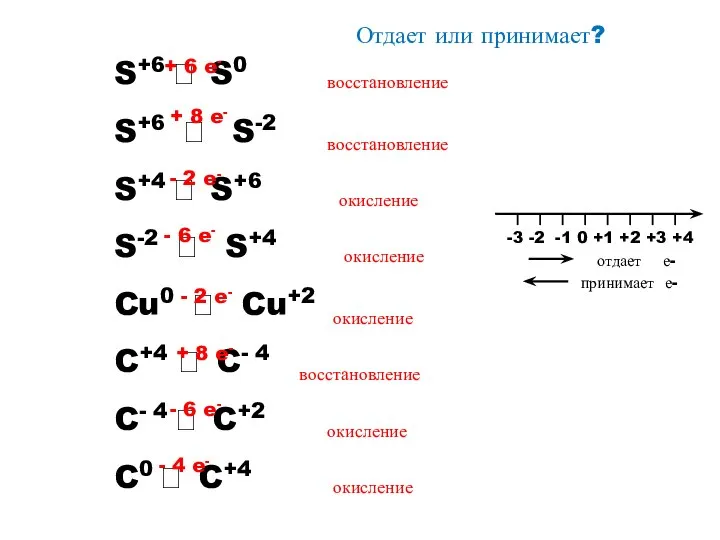
- 7. Отдает или принимает? S+6 ? S0 S+6 ? S-2 S+4 ? S+6 S-2 ? S+4 Cu0
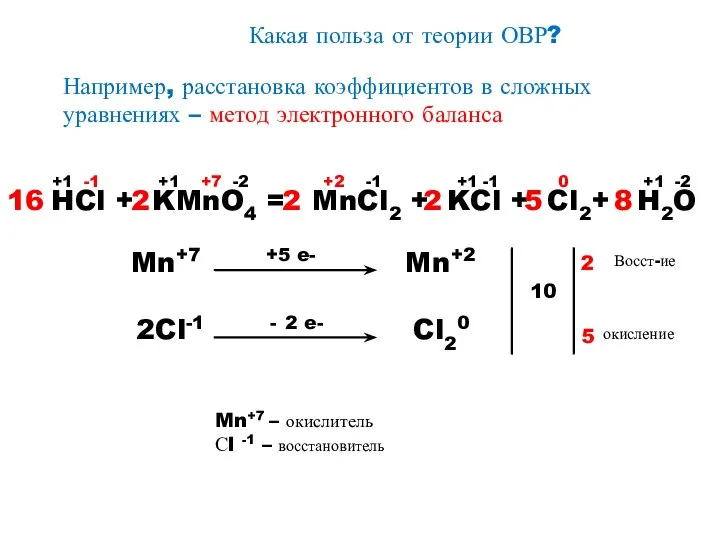
- 8. Какая польза от теории ОВР? Например, расстановка коэффициентов в сложных уравнениях – метод электронного баланса HCl
- 9. Расставьте коэффициенты методом электронного баланса. Al + MnO2 = Al2O3 + Mn Fe2O3 + Zn =
- 10. ОВР в быту
- 11. Выяснить, как окислительно-восстановительные реакции применяются в быту. Цель работы:
- 12. Вы пролили йод на белую салфетку. Хлорная известь и персоль не обесцветят пятно йода. Вывести пятно
- 13. При обработке персолью отбеливание происходит за счет окисления загрязнений 2H2O2=2H2O+O2. Для того чтобы образующийся кислород не
- 14. С помощью пероксида водорода реставрируют старинные картины. Промывая пероксидом водорода старые картины, сульфид переводят в белый
- 15. Выводы Мы часто сталкиваемся с окислительно-восстановительными реакциями в быту: при избавлении от пятен йода на ткани;
- 16. Покажите электронные переходы в следующих схемах ОВР Назовите окислитель и восстановитель Li0 + O20 => Li2O
- 17. Из приведенных схем уравнений реакций выпишите те, которые можно отнести к ОВР СаСО3 => СаО +
- 18. Расставьте коэффициенты методом электронного баланса в следующих схемах ОВР Определите окислитель, восстановитель 1)С-4Н4+1 + 2О20 =>
- 19. Домашнее задание: Параграф 43, вопросы письменно 1,3,7 Предложите на звание «чуда» примеры из цикла наук предметов
- 21. Скачать презентацию













 Гидролиз солей – частный случай РИО
Гидролиз солей – частный случай РИО Презентация на тему Состав, строение и свойства стекла и хрусталя
Презентация на тему Состав, строение и свойства стекла и хрусталя  Электрохимические процессы
Электрохимические процессы pervonachalnye_svedenia_ob_org_v-kh
pervonachalnye_svedenia_ob_org_v-kh Пятичленные гетероциклы с двумя и более атомами азота
Пятичленные гетероциклы с двумя и более атомами азота Увлекательный мир химии
Увлекательный мир химии Учёные-химики в годы Великой Отечественной войны
Учёные-химики в годы Великой Отечественной войны Углерод
Углерод Основания
Основания Методы получения нафтиридинов (всех изомеров)
Методы получения нафтиридинов (всех изомеров) Составление формул оксидов, оснований, солей
Составление формул оксидов, оснований, солей Химический состав клетки
Химический состав клетки Презентация в 8 классе к уроку по химии на тему__
Презентация в 8 классе к уроку по химии на тему__ Фотохромные биоматериалы. Применение спиропирановых систем в медицине
Фотохромные биоматериалы. Применение спиропирановых систем в медицине Электролитическая диссоциация веществ Реакции ионного обмена и условия их протекания
Электролитическая диссоциация веществ Реакции ионного обмена и условия их протекания Пусть имя Д.И. Менделеева будет нашей путеводной звездой
Пусть имя Д.И. Менделеева будет нашей путеводной звездой Химия в космосе Автор: Гриб Яна ученица 8а класса школа №484. Научный руководитель: Бирюкова Зоя Владимировна.
Химия в космосе Автор: Гриб Яна ученица 8а класса школа №484. Научный руководитель: Бирюкова Зоя Владимировна. Вода как хладагент (R718)
Вода как хладагент (R718) AMFOTERNOST__1
AMFOTERNOST__1 Алкины
Алкины Альдегиды и кетоны (часть 2)
Альдегиды и кетоны (часть 2) Презентация на тему Роль йода в организме
Презентация на тему Роль йода в организме  Перегонка. Вклад алхимиков в органическую химию
Перегонка. Вклад алхимиков в органическую химию Коррозия металлов
Коррозия металлов Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс Нефть. Её состав. Термический и каталитический крекинг
Нефть. Её состав. Термический и каталитический крекинг Технологические особенности никеля и никелевых сплавов
Технологические особенности никеля и никелевых сплавов Презентация на тему Бром
Презентация на тему Бром