Содержание
- 2. Мета: сформувати поняття: «окисно-відновна реакція», «процес окиснення», «процес відновлення», «окисник», «відновник»; навчити визначати окисно-відновні реакції за
- 3. Що таке ступінь окиснення? Чому дорівнює ступінь окиснення простих речовин? Яке значення мають ступені окиснення металів
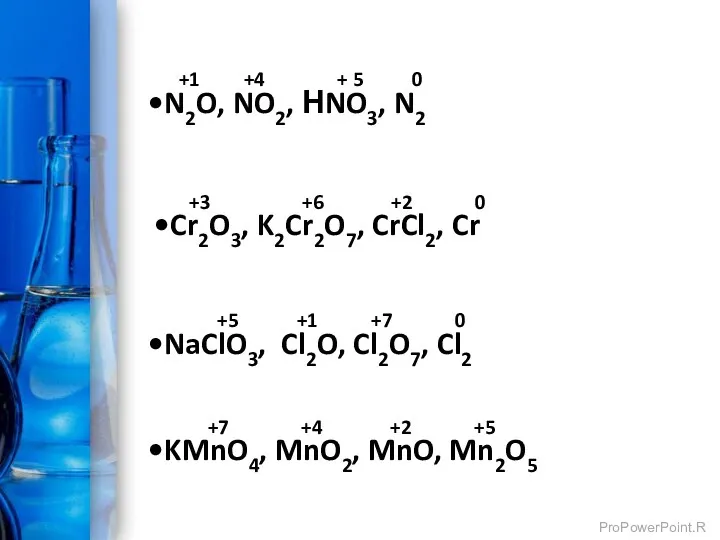
- 4. +1 +4 + 5 0 N2O, NO2, НNO3, N2 +3 +6 +2 0 Cr2O3, K2Cr2O7, CrCl2,
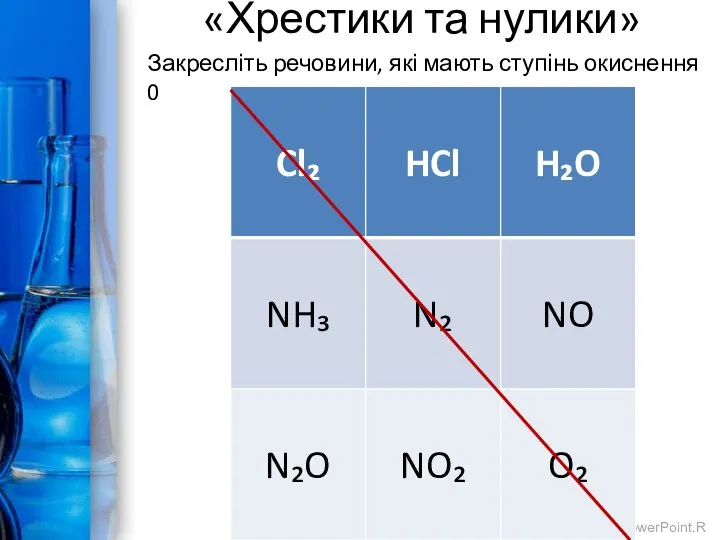
- 5. «Хрестики та нулики» Закресліть речовини, які мають ступінь окиснення 0
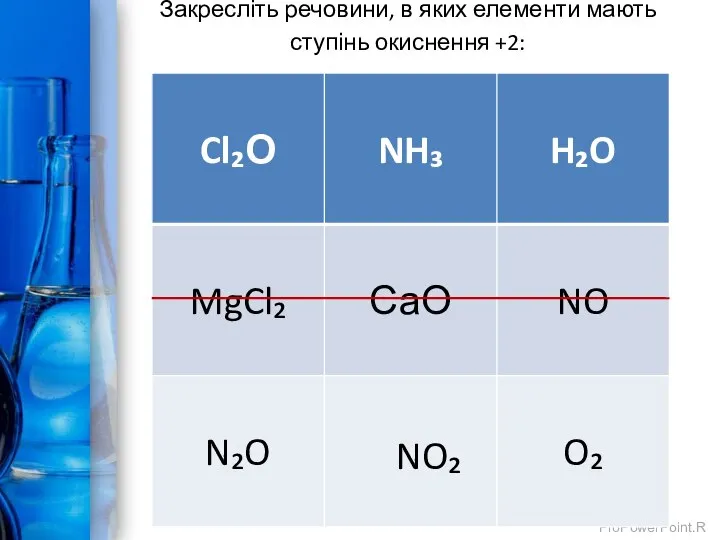
- 6. Закресліть речовини, в яких елементи мають ступінь окиснення +2:
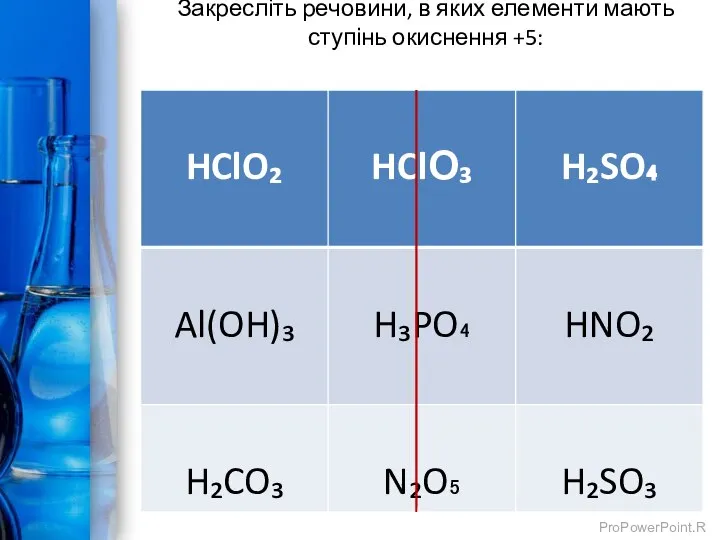
- 7. Закресліть речовини, в яких елементи мають ступінь окиснення +5:
- 8. +5 -2 +1 -2 +1+5 -2 1. N2O5 + H2O → 2HNO3 0 0 +2 -2
- 9. Окисно-відновні реакції (ОВР) – це реакції, у яких хоча б один хімічний елемент змінює свій ступінь
- 10. Окиснення – це процес віддачі електронів атомом (йоном) з підвищенням ступеня окиснення. 0 +2 N –
- 11. Відновлення – це процес приєднання електронів атомом (йоном) зі зниженням ступеня окиснення. 0 -2 O +
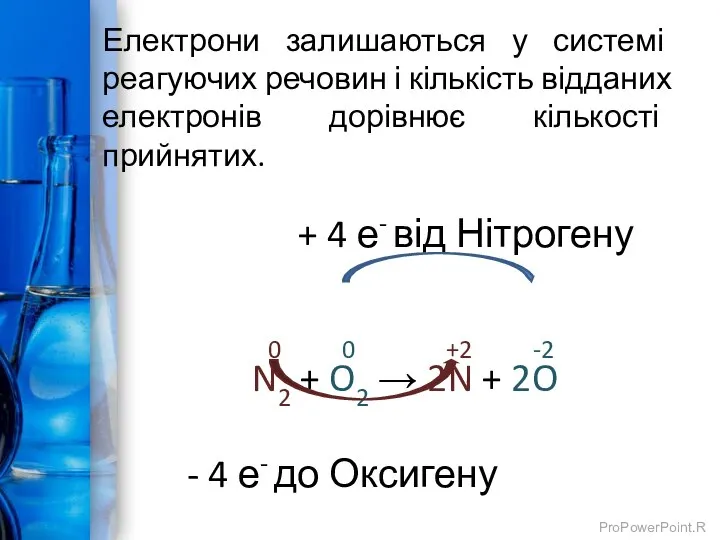
- 12. + 4 е- від Нітрогену 0 0 +2 -2 N2 + O2 → 2N + 2O
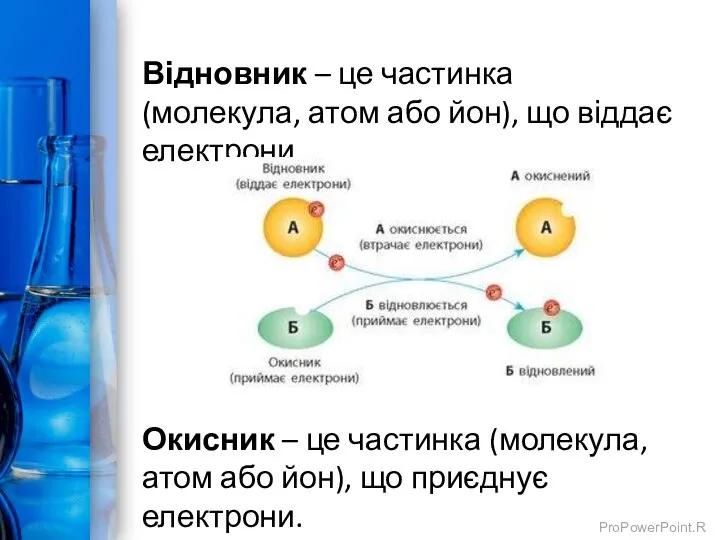
- 13. Відновник – це частинка (молекула, атом або йон), що віддає електрони. Окисник – це частинка (молекула,
- 14. У підручнику «Вступ до хімії» (1926 року) вперше виклав весь матеріал хімії з позиції електронної теорії
- 21. Вставити кількість приєднаних або відданих електронів, визначити процеси окиснення та відновлення, окисник та відновник. а) N+⁵
- 22. Закінчити схеми, вказати окисник і відновник, процеси окиснення і відновлення: 0 а) N + 3e →
- 23. Висновки: 1. ОВР – це реакції, під час яких відбувається перехід електронів. 2. ОВР так називаються
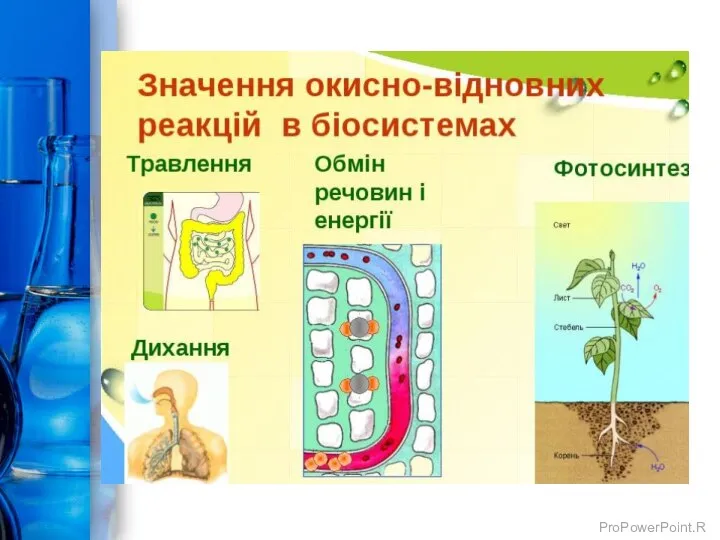
- 24. Значення окисно-відновних реакцій ОКИСНО-ВІДНОВНІ ПРОЦЕСИ – одні з найважливіших процесів природи. Ці реакції належать до числа
- 26. Скачать презентацию


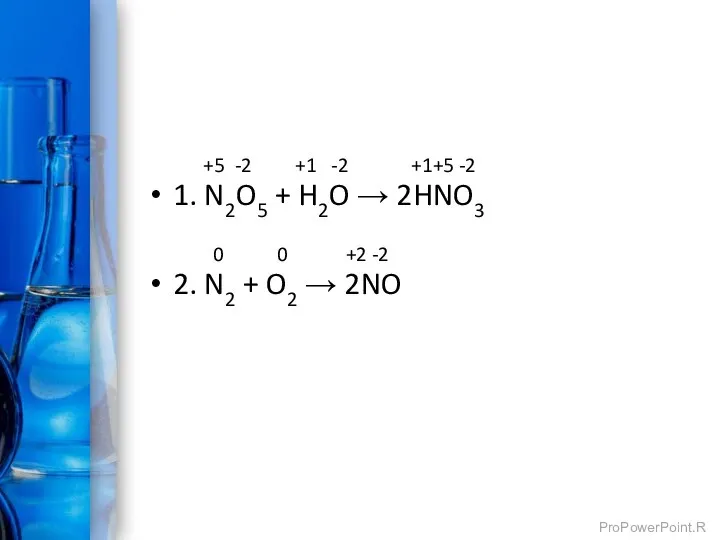













 Химия в косметологии
Химия в косметологии Органические цепочки
Органические цепочки Фосфорная кислота и ее свойства
Фосфорная кислота и ее свойства Очистка поверхности медного сплава
Очистка поверхности медного сплава Химические свойства амфотерных оксидов и гидроксидов
Химические свойства амфотерных оксидов и гидроксидов Исследование снега на общую химическую токсичность методом биотестирования Автор: Милюта Юлия, Тюменская область, Тюменский рай
Исследование снега на общую химическую токсичность методом биотестирования Автор: Милюта Юлия, Тюменская область, Тюменский рай Химический элемент натрий
Химический элемент натрий Азотсодержащие. Амины (семинар)
Азотсодержащие. Амины (семинар) Презентация на тему Электролиз: что полезно знать
Презентация на тему Электролиз: что полезно знать  Химические методы. CVD, СВС, термоциклирование вблизи температуры фазового перехода
Химические методы. CVD, СВС, термоциклирование вблизи температуры фазового перехода Презентация на тему Жидкий металл - ртуть
Презентация на тему Жидкий металл - ртуть  Распределение электронов по энергетическим уровням
Распределение электронов по энергетическим уровням Строение атома
Строение атома Развитие творческих способностей школьников на уроках химии
Развитие творческих способностей школьников на уроках химии Химия в жизни общества
Химия в жизни общества Исследование свойств многоатомных спиртов
Исследование свойств многоатомных спиртов Презентация на тему Благородные газы
Презентация на тему Благородные газы  Ca КАЛЬЦИЙ
Ca КАЛЬЦИЙ Чистые вещества и смеси, их разделение
Чистые вещества и смеси, их разделение Характеристика химического элемента по его положению в периодической системе элементов Д. И. Менделеева
Характеристика химического элемента по его положению в периодической системе элементов Д. И. Менделеева Презентация на тему Молярный объем
Презентация на тему Молярный объем  Методы исследования структуры кристаллов
Методы исследования структуры кристаллов Природные источники углеводородов
Природные источники углеводородов Введение в органическую химию
Введение в органическую химию Серная кислота
Серная кислота Ковалентная связь. Радикалы
Ковалентная связь. Радикалы Характеристика углеводородов
Характеристика углеводородов Масляная кислота
Масляная кислота