Содержание
- 2. Железо-никелевые метеориты
- 3. Железо составляет большую часть земного ядра.
- 5. Fe
- 7. Железо — это простое вещество, металл, серебристо-белого цвета; его плотность 7,87 г/см3, температура плавления 1539 °C.
- 9. 26Fe 2e 8e 14e 2e – – – – –
- 10. Опты №1 3Fe + 2O2 = Fe3O4 + Q
- 11. При взаимодействии железа с галогенами (кроме йода) оно образует галогениды. 2Fe + 3Cl2 = 2FeCl3
- 12. При нагревании смеси железных опилок и порошка серы образуется сульфид железа (II). Fe + S =
- 13. Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Co, Sn, Pb, H, Cu,
- 14. Железо восстанавливает из водных растворов солей металлы, расположенные правее в электрохимическом ряду напряжений. Если в реакцию
- 15. При восстановлении железом еще менее активных металлов, например, серебра из соли серебра, железо переходит в соединение,
- 16. Свойства оксидов Оксид железа(II) FeO обладает основными свойствами, ему отвечает основание Fe(OH)2. Оксид железа(III) Fe2O3 слабо
- 17. Свойства оксидов Гидроксид железа(III) Fe(OH)3 проявляет слабо амфотерные свойства, он способен реагировать только с концентрированными растворами
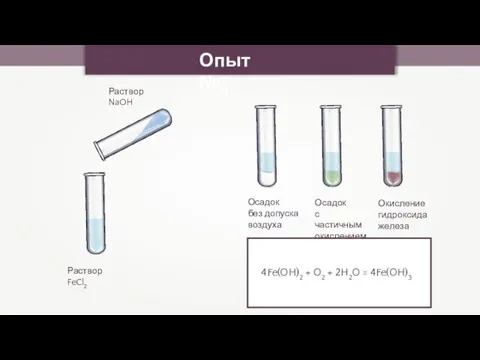
- 18. Раствор FeCl2 Раствор NaOH Осадок без допуска воздуха Опыт №2 Осадок с частичным окислением Окисление гидроксида
- 19. Железо Alchemist-hp
- 20. Железо в промышленности Красный железняк Красный железняк Norbert Kaiser
- 21. По запасу железных руд Россия занимает первое место в мире. Они залегают на Урале, в Курской
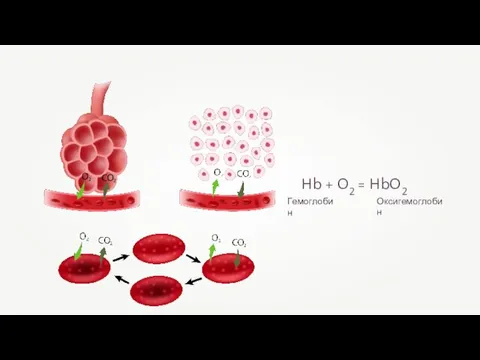
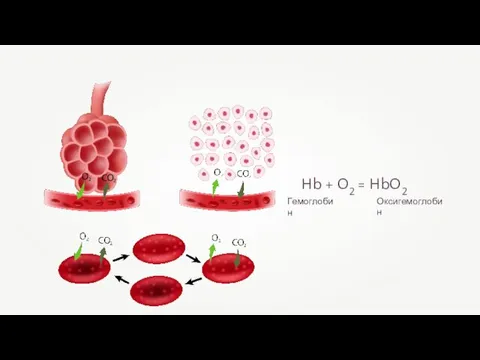
- 23. Hb + O2 = HbO2 Оксигемоглобин Гемоглобин
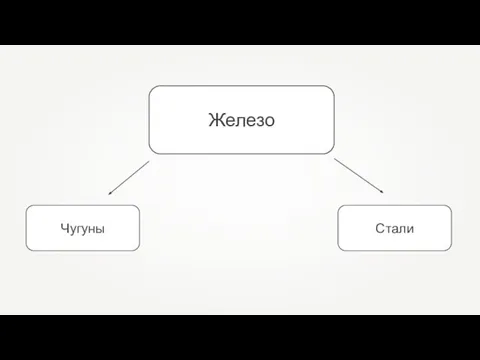
- 25. Железо
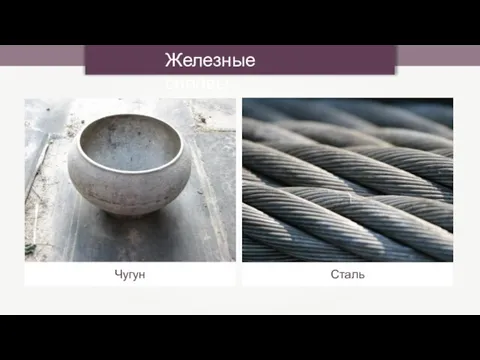
- 26. Железные сплавы Чугун Сталь
- 27. В чугуне содержится углерода больше, чем железо может удержать его при затвердевании в виде твердого раствора.
- 28. Особенность чугуна: при затвердевании он не сжимается, как большинство металлов, а расширяется. Поэтому чугун можно использовать
- 29. Решётка Летнего Сада
- 30. Сталь
- 31. Свойства стали в закаленном состоянии зависят от массовой доли в ней углерода: чем больше в стали
- 33. Легированная сталь
- 35. Быстрорежущая сталь
- 36. Нержавеющая сталь
- 37. Нержавеющие стали широко применяют в химической, машиностроительной, пищевой отраслях промышленности. В быт нержавеющая сталь вошла в
- 38. Арки станции метро «Маяковская» московского метрополитена Eugeny1988
- 39. Содержание железа у взрослого человека: 2–5 г. Содержание железа у взрослого человека: 300–400 мг.
- 41. Hb + O2 = HbO2 Оксигемоглобин Гемоглобин
- 42. Железо выполняет множество важнейших функций, основная из которых — поддержание постоянного уровня гемоглобина в крови.
- 43. Анемия
- 47. Скачать презентацию



































 Самостоятельные работы по разделу Химические реакции в рамках рабочей программы по химии для 8 класса
Самостоятельные работы по разделу Химические реакции в рамках рабочей программы по химии для 8 класса Щелочные металлы
Щелочные металлы Еще раз про электролиз…
Еще раз про электролиз… Химический опыт с горением борноэтилового эфира
Химический опыт с горением борноэтилового эфира Расчетная ячейка при МД моделировании. Граничные условия. Элементарная ячейка для атомов аргона
Расчетная ячейка при МД моделировании. Граничные условия. Элементарная ячейка для атомов аргона Синтез бензотиазин -S,S- диоксидов и тозилцинамонитрилов
Синтез бензотиазин -S,S- диоксидов и тозилцинамонитрилов Химический состав клетки
Химический состав клетки Вывод формул химических веществ
Вывод формул химических веществ Презентация на тему Синтетические моющие средства
Презентация на тему Синтетические моющие средства  MPKh_PREZENTATsIYa_2
MPKh_PREZENTATsIYa_2 Химические и физические явления
Химические и физические явления Первоначальные химические понятия. 2 раунд
Первоначальные химические понятия. 2 раунд Полезные ископаемые
Полезные ископаемые Алюминий. Свойства элементов подгруппы алюминия
Алюминий. Свойства элементов подгруппы алюминия Кислородные соединения азота, азотная кислота. Соли азотной кислоты. Удобрения
Кислородные соединения азота, азотная кислота. Соли азотной кислоты. Удобрения Химическая организация клетки
Химическая организация клетки Использование элементов модульной технологии на уроках химии
Использование элементов модульной технологии на уроках химии Презентация на тему Круговорот углерода в природе
Презентация на тему Круговорот углерода в природе  Чистые вещества и смеси
Чистые вещества и смеси Кинетика химических и биохимических процессов. Часть 1
Кинетика химических и биохимических процессов. Часть 1 Технические материалы. Металлические и неметаллические. (Тема 1)
Технические материалы. Металлические и неметаллические. (Тема 1) Жиры. Классификация
Жиры. Классификация ОГЭ №2, вопрос 1-16
ОГЭ №2, вопрос 1-16 Химические формулы. Относительная молекулярная масса. 8 класс
Химические формулы. Относительная молекулярная масса. 8 класс Типы химических реакций
Типы химических реакций Презентация на тему: Изомерия
Презентация на тему: Изомерия Дополнительный_материал_11.15_23.09.2022_e4f87550
Дополнительный_материал_11.15_23.09.2022_e4f87550 Схема монооксигеназной цепи микросом
Схема монооксигеназной цепи микросом