Содержание
- 2. Основные вопросы лекции: 1. Распределение электронной плотности в альдегидах, кетонах. Реакционные центры. 2. Механизм реакций нуклеофильного
- 3. 8. Реакционные центры и механизм реакций нуклеофильного замещения SN карбоновых кислот. 9. Реакции этерификации и гидролиза
- 4. Карбонильные соединения Соединения, содержащие С=О (оксо-группу), называются карбонильными. Существует два класса карбонильных соединений: (А) Альдегиды и
- 5. Распределение электронной плотности в альдегидах, реакционные центры H O R C C H Н нуклеофильный центр
- 6. Распределение электронной плотности в кетонах, реакционные центры H R C C R1 Н O CH-кислотный центр
- 7. Вследствие различия электроотрицательности атомов кислорода и углерода π-связь между ними в карбонильной группе сильно поляризована. В
- 8. Реакционная способность у альдегидов и кетонов обусловлена наличием: электрофильного центра - реакции нуклеофильного присоединения АN :
- 9. Реакции нуклеофильного присоединения АN Механизм AN pH > 7: +N:̶ R + HОH R R→C=O →
- 10. Закономерности реакционной способности альдегидов и кетонов в реакциях АN Легкость электрофильной атаки зависит от величины эффективного
- 11. Влияние электронных эффектов на реакции АN С учетом с электронных эффектов групп, связанных с карбонильным атомом
- 12. Пространственная доступность электрофильного центра (карбонильного углерода) для атаки нуклеофила уменьшается при замене водорода на объемистые органические
- 13. Реакции нуклеофильного присоединения АN 1. О – нуклеофильные реагенты: НОН (реакция гидратации), R – ОН, С6Н5ОН
- 14. Присоединение спиртов к альдегидам и кетонам – реакция ацетализации альдегид спирт полуацеталь Альдегиды, содержащие гидроксильную группу,
- 15. Пример реакции ацетализации - АN (механизм) + Н+ + С2Н5ОН - Н+ + Н+ Н +
- 16. Реакции нуклеофильного присоединения АN 2. N - нуклеофильные реагенты: NH3, H2N-CHR2, R-NH2, (R3)N (реакции присоединения аммиака,
- 17. Реакции нуклеофильного присоединение аммиака, аминов и их производных присоединение АN элиминирование амин кетон кетимин (аммиак) (альдегид)
- 18. Реакции нуклеофильного присоединения АN 3. C – нуклеофильные реагенты: альдегиды, кетоны. (альдольная, кротоновая конденсации). АЛЬДОЛЬНАЯ КОНДЕНСАЦИЯ:
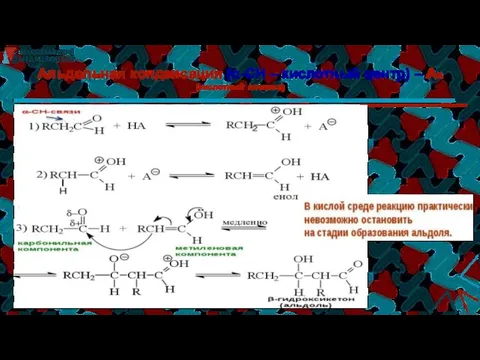
- 19. Альдольная конденсация (α-СН – кислотный центр) – АN (щелочной катализ) ОН–, 10°С Н2О енолят- ион 1
- 20. Альдольная конденсация (α-СН – кислотный центр) – АN (кислотный катализ)
- 21. Кротоновая конденсация Если реакцию конденсации проводить в более жестких условиях (при нагревании и в кислой среде),то
- 22. Реакции окисления-восстановления Окислением в органической химии называют процесс удаления атомов водорода с образованием кратной связи или
- 23. Реакция дисмутации + Н2О Главное в механизме реакции дисмутации – перенос водорода в виде гидрид-иона (отрицательно
- 24. Механизм реакции дисмутации АN НО С О Н Н - 2 стадия - анион I взаимодействует
- 25. 2. Реакции окисления Альдегиды легко окисляются до карбоновых кислот большинством окислителей KMnO4,K2Cr2O7 и т.д.(даже кислородом воздуха).
- 26. Галоформная реакция (обнаружение кетоновых тел в биожидкостях) Кетоновые тела: ацетон β-гидроксимасляная кислота СН3-СН(ОН)-СН2-СООН ацетоуксусная кислота СН3-СО-СН2-СООН
- 27. Галоформная реакция 3 I2; 3 NaOH I I C C CH3 I O - 3 NaI;
- 28. Биороль альдегидов и кетонов 1. В природе: ванилин, корица, камфора, цитраль, формальдегид. 2. Метаболиты организма: ацетон,
- 29. Реакции нуклеофильного замещения у SP2 – гибридного атома углерода.
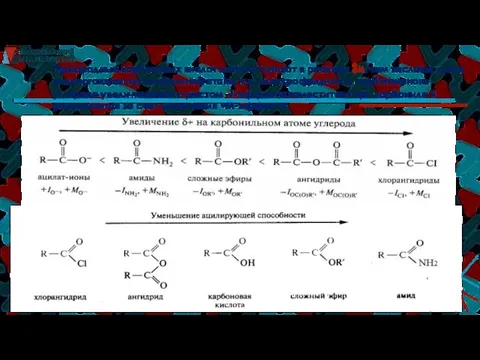
- 30. ЭЛЕКТРОННОЕ СТРОЕНИЕ КАРБОНОВЫХ КИСЛОТ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ РАДИКАЛОВ (Э.Д. – Э.А): Н3С–СООН рКа 4,75 3,75 2,80 0,70
- 31. Химические свойства карбоновых кислот и их функциональных производных: Кислотные свойства – реакции происходят по ОН-кислотному центру
- 32. Нуклеофильное замещение SN – реакции происходят по электрофильному центру Нижник Я.П. http://norgchem.professorjournal.ru
- 33. Производные карбоновых кислот легче вступают в реакции SN, чем кислоты, легче подвергаются нуклеофильной атаке, т.к. электрофильность
- 34. 2. Образование сложных эфиров (SN). Реакция этерификации – взаимодействие карбоновых кислот и спиртов. уксусная кислота этиловый
- 35. Гидролиз сложных эфиров под действием щелочи Механизм SN Нижник Я.П. http://norgchem.professorjournal.ru
- 36. 1. Синтез и ферментативное расщепление жиров в организме (в верхнем отделе 12-перстной кишки, ферменты – липазы,
- 37. ПЕРЕНОС АЦИЛЬНЫХ ГРУПП Ацилфосфаты играют важную роль в биохимических процессах как переносчики АЦИЛЬНЫХ групп, например ацетилфосфат.
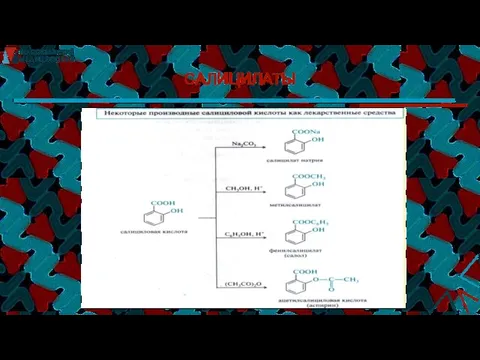
- 38. САЛИЦИЛАТЫ
- 39. МЕСТНОАНЕСТЕЗИРУЮЩИЕ ПРЕПАРАТЫ
- 40. 3. Образование галогенангидридов Атомы галогена в галогенангидридах могут легко замещаются при действии различных нуклеофилов, поэтому галогенангидриды
- 41. ацетилхлорид этилацетат (сложный эфир) ацетилхлорид ацетамид (амид) Нижник Я.П. http://norgchem.professorjournal.ru ОБРАЗОВАНИЕ И ГИДРОЛИЗ АМИДОВ ОБРАЗОВАНИЕ СЛОЖНЫХ
- 42. ОБРАЗОВАНИЕ И ГИДРОЛИЗ АМИДОВ Синтез амидов С2Н5 О Н5С2 С=О + NН3 Н2N С ←О Н5С2
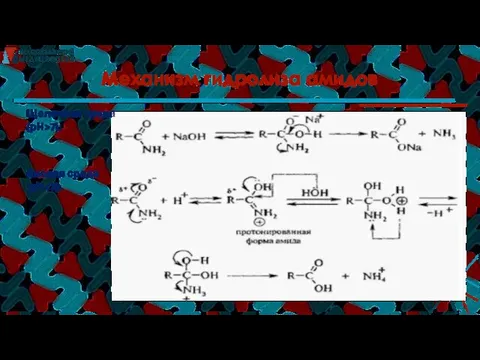
- 43. Механизм гидролиза амидов Щелочная среда (рН>7): Кислая среда (рН
- 44. Белки и пептиды также являются амидами, в которых амидная связь (которая в биохимии называется пептидной связью)
- 45. анилин aцетанилид Ацетанилид . Бесцветные кристаллы, tпл 114,3 °С. Первое лекарственное вещество, полученное синтетически; обладает жаропонижающим
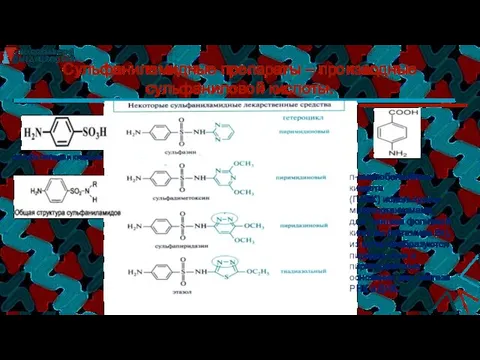
- 46. Сульфаниламидные препараты – производные сульфаниловой кислоты. сульфаниловая кислота п-аминобензойная кислота (ПАБК) используется микроорганизмами, для синтеза фолиевой
- 48. Скачать презентацию








































 Молярный объем газов. Закон Авогадро
Молярный объем газов. Закон Авогадро Химия. Кроссворд
Химия. Кроссворд Органические вещества клетки. Липиды. (10 класс)
Органические вещества клетки. Липиды. (10 класс) Графен. Нобелевская премия 2016
Графен. Нобелевская премия 2016 Замедленное коксование нефтяного сырья
Замедленное коксование нефтяного сырья Структура металлов, сплавов, интерметаллидов и квазикристаллов
Структура металлов, сплавов, интерметаллидов и квазикристаллов Скорость химической реакции
Скорость химической реакции Химические реакции в органической химии
Химические реакции в органической химии Периодическая система химических элементов. Дмитрий Иванович Менделеев
Периодическая система химических элементов. Дмитрий Иванович Менделеев Амины. Аминокислоты
Амины. Аминокислоты Условия, замедляющие выход водорастворимых питательных веществ из удобрений на примере аммофоса
Условия, замедляющие выход водорастворимых питательных веществ из удобрений на примере аммофоса Химическое равновесие и способы его смещения. Принцип Ле Шателье. 9 класс
Химическое равновесие и способы его смещения. Принцип Ле Шателье. 9 класс Классификация органических реакций, реагентов
Классификация органических реакций, реагентов Енергетика хімічних процесів
Енергетика хімічних процесів Решение задач ЕГЭ
Решение задач ЕГЭ Железо и его соединения
Железо и его соединения Сравнительная характеристика бензольного кольца и олимпийских колец
Сравнительная характеристика бензольного кольца и олимпийских колец Составление химических формул методом нулевой суммы
Составление химических формул методом нулевой суммы Средства для мытья окон
Средства для мытья окон Аммиак. Состав вещества
Аммиак. Состав вещества Презентация на тему Амфотерные оксиды и гидроксиды
Презентация на тему Амфотерные оксиды и гидроксиды  Коррозия металлов и борьба с ней. Лабораторная работа
Коррозия металлов и борьба с ней. Лабораторная работа prezentatsiya-po-fizike-7-klass-tri-agregatnyh-sostoyaniya-veshchestva
prezentatsiya-po-fizike-7-klass-tri-agregatnyh-sostoyaniya-veshchestva Химия в еде
Химия в еде Презентация на тему Кремний в природе
Презентация на тему Кремний в природе  Вводный урок по химии
Вводный урок по химии Амфотерность оксида и гидроксида алюминия
Амфотерность оксида и гидроксида алюминия Физические свойства неметаллов
Физические свойства неметаллов