Содержание
- 2. Основные понятия Растворы – гомогенная (однофазная) система переменного состава, образованная растворителем, растворенным веществом и продуктами их
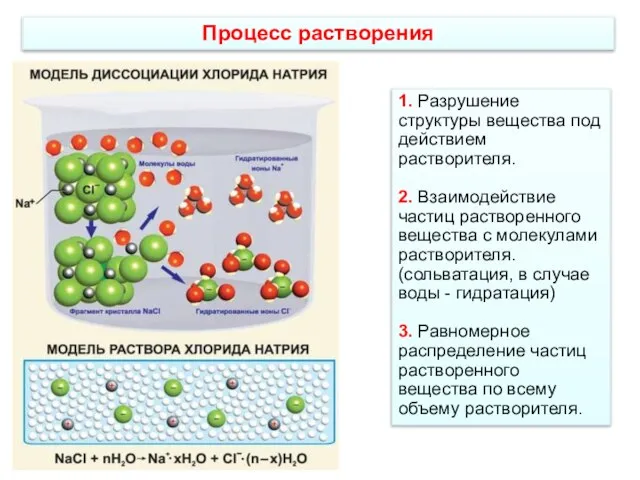
- 3. Процесс растворения 1. Разрушение структуры вещества под действием растворителя. 2. Взаимодействие частиц растворенного вещества с молекулами
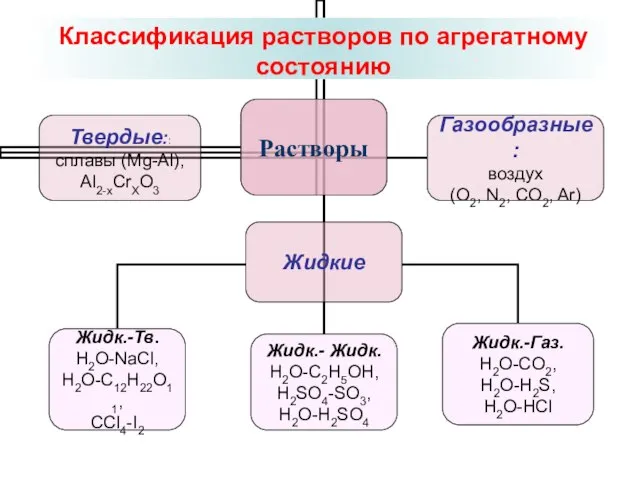
- 4. Классификация растворов по агрегатному состоянию
- 5. Газообразные растворы раствор кислорода и углекислого газа в азоте – воздух Жидкие растворы Жид.+Газ Жид.+Жид. Жиж.+Тв.
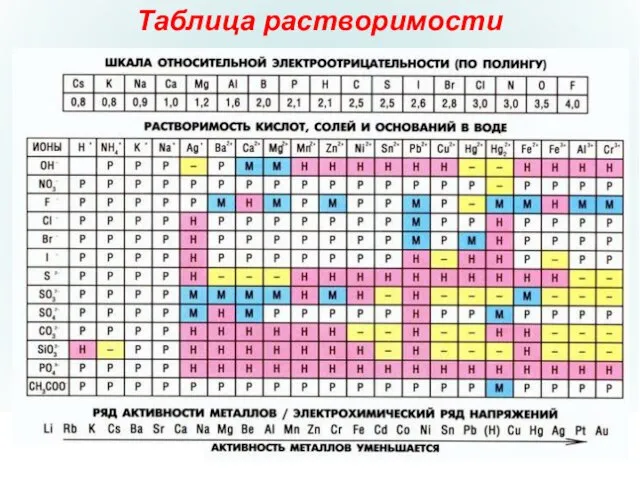
- 6. Таблица растворимости
- 7. Растворы Коэффициент растворимости показывает сколько граммов вещества может растворяться в 100 г растворителя. В соответствии с
- 8. Растворы Ненасыщенный раствор — раствор, в котором при данных условиях можно растворить еще некоторое количество растворенного
- 9. Способы выражения состава растворов Массовая доля вещества (или процентная концентрация) — отношение массы растворенного вещества, к
- 10. Способы выражения состава растворов Молярная концентрация или молярность — количество молей растворенного вещества в одном литре
- 11. Способы выражения состава растворов Молярная концентрация эквивалента (нормальная концентрация или нормальность) — число грамм-эквивалентов данного вещества
- 12. Способы выражения состава растворов Моляльная концентрация (моляльность) — показывает количество молей n растворенного вещества в 1
- 13. Способы выражения состава растворов Мольная доля вещества — отношение количества растворенного вещества к сумме количеств всех
- 14. Электролитическая диссоциация Аррениус Сванте Август (19.11.1859 – 2.10.1927 г.) – шведский физик и химик, один из
- 15. Электролиты и неэлектролиты Неэлектролиты – вещества, которые не проводят электрический ток ни в растворах, ни в
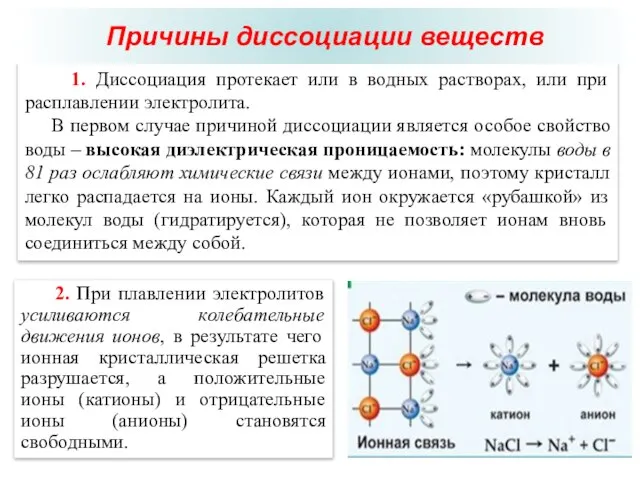
- 16. Д.У. Гиббс (1839 – 1903) 1. Диссоциация протекает или в водных растворах, или при расплавлении электролита.
- 17. Кислотами называют электролиты, которые при диссоциации образуют катионы только H+, например: HNO3 ↔ H+ + NO3-
- 18. Диссоциация оснований Основаниями называют электролиты, которые при диссоциации образуют анионы только OH-, например: NaOH ↔ Na+
- 19. Диссоциация солей Солями называют электролиты, которые при диссоциации образуют катионы металла (или аммония NH4+) и анионы
- 20. Степень диссоциации и сила электролита Сила электролитов определяется их степенью диссоциации – α (альфа). Степень диссоциации
- 21. Константа диссоциации Слабые электролиты в процессе диссоциации подчиняются закону действующих масс. Между ионами и недиссоциированными молекулами
- 22. Электролитическая диссоциация воды Вода – слабый амфотерный электролит, диссоциирует: H2O ↔ H+ + OH- Молярная концентрация
- 24. Скачать презентацию

















 Карбонильные соединения
Карбонильные соединения Структура к свойства веществ
Структура к свойства веществ Презентация на тему Применение электролиза
Презентация на тему Применение электролиза  Хімічні формули
Хімічні формули Химическая термодинамика
Химическая термодинамика Презентация на тему Химический состав клетки. Неорганические соединения
Презентация на тему Химический состав клетки. Неорганические соединения  Типы химических реакций. Что такое химическая реакция?
Типы химических реакций. Что такое химическая реакция? Кислород. Применение и круговорот в природе. 8 класс
Кислород. Применение и круговорот в природе. 8 класс Сильные и слабые электролиты
Сильные и слабые электролиты Физические свойства водорода
Физические свойства водорода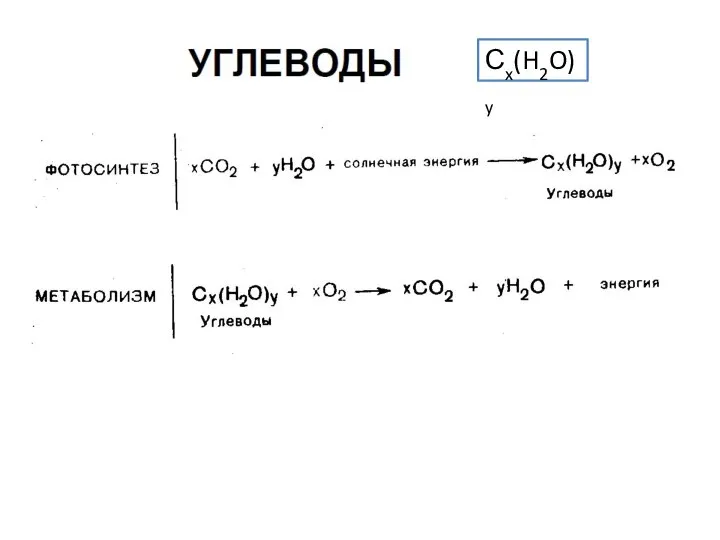 Углеводы. Классификация, cтроение
Углеводы. Классификация, cтроение Медь и ее сплавы
Медь и ее сплавы Углеродные материалы. Основные понятия и определения. Области их применения
Углеродные материалы. Основные понятия и определения. Области их применения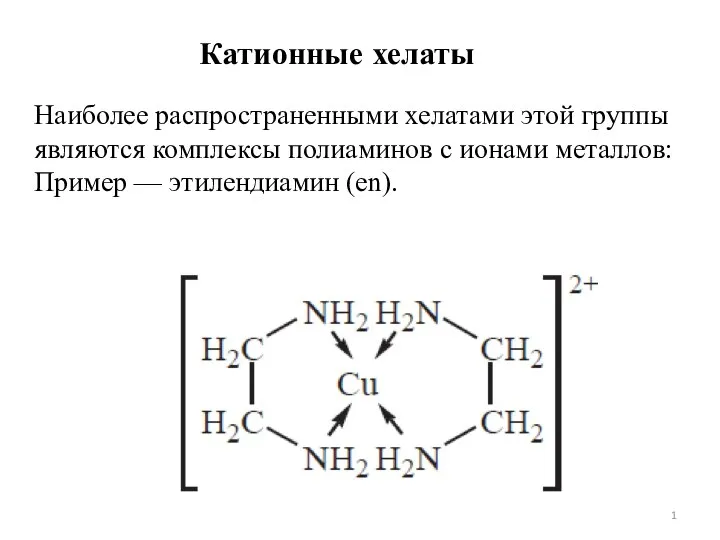 Хелатный эффект. Лекция 7
Хелатный эффект. Лекция 7 Проверочные работы по темам: Неметаллы. 9 класс
Проверочные работы по темам: Неметаллы. 9 класс Проведение лабраторных общеклинических исследований
Проведение лабраторных общеклинических исследований Карбоновые кислоты
Карбоновые кислоты Углеводы, 2 часть. Лекция 15
Углеводы, 2 часть. Лекция 15 Химическое ассорти
Химическое ассорти Модель Томпсона. Модель Резерфорда
Модель Томпсона. Модель Резерфорда Элементарный химический состав белков
Элементарный химический состав белков Химическая кинетика. Экзаменационные вопросы
Химическая кинетика. Экзаменационные вопросы Минералы и их свойства
Минералы и их свойства Создание раствора для ингибирования коррозии черных металлов и его утилизация на удобрения
Создание раствора для ингибирования коррозии черных металлов и его утилизация на удобрения Зависимость знака заряда белка от pH
Зависимость знака заряда белка от pH Описание молекул
Описание молекул Генетическая связь между основными классами неорганических соединений
Генетическая связь между основными классами неорганических соединений Композитные материалы
Композитные материалы