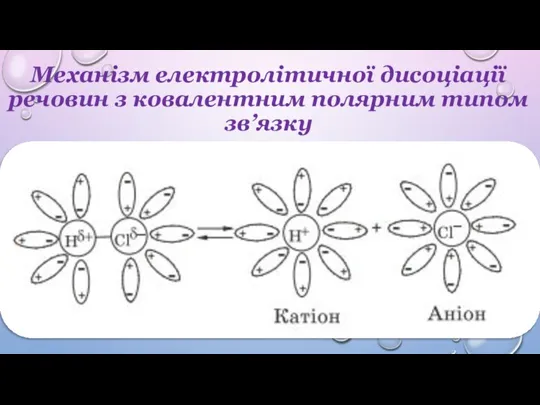
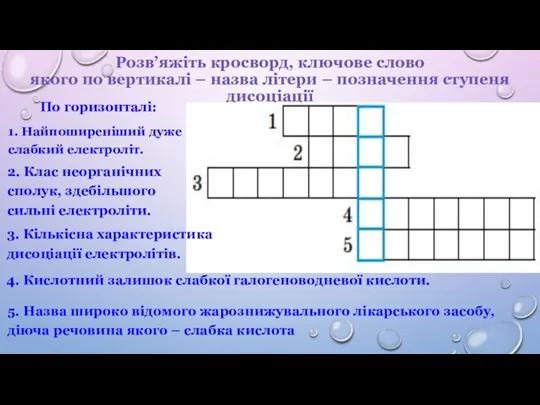
електроліту, його молекули розпадаються на йони (утворюються катіони та аніони) – відбувається електролітична дисоціація (іонізація).
Сумарний заряд катіонів дорівнює сумарному заряду аніонів, унаслідок чого розчин є електронейтральним.
Позитивно заряджені йони називають катіонами (H+, NH4+, іони металів Na+, Al3+ тощо)
Негативно заряджені йони називають аніонами (OH–, кислотні залишки F–, СO32–, HSO4– тощо)
2. Хімічні властивості йонів відрізняються від властивостей атомів.
3. При пропусканні електричного струму через розчин до негативного полюса переміщуються катіони, а до позитивного – аніони.
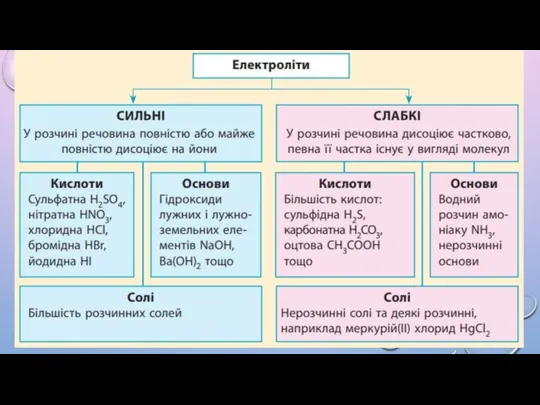
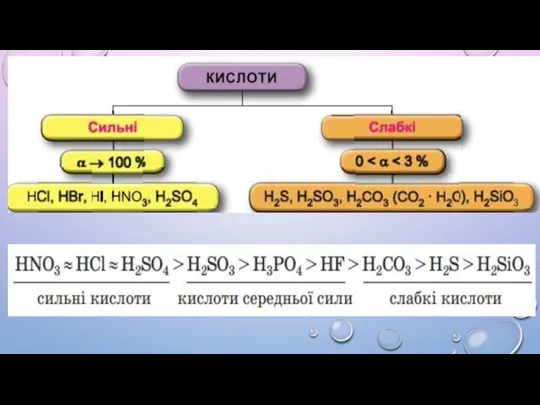
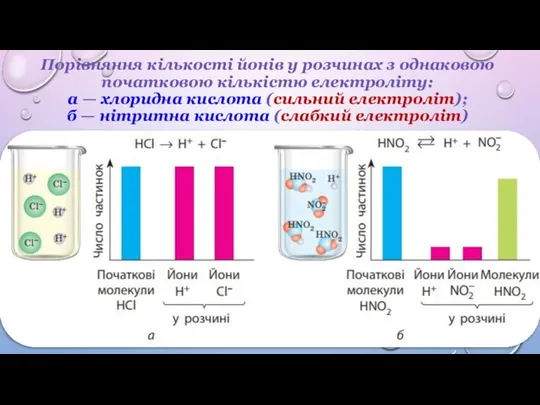
4. Електролітична дисоціація – процес оборотний.







 4505ab8713f54e72bb388461c5e134ac (1)
4505ab8713f54e72bb388461c5e134ac (1)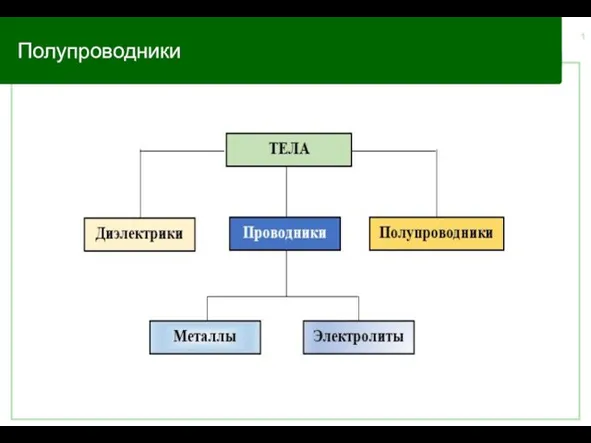 Полупроводники. Германий и кремний
Полупроводники. Германий и кремний Циклоалканы (циклопарафины)
Циклоалканы (циклопарафины) Химия и производство
Химия и производство ТЭЦ, работающие на каменном угле более экологичны, чем на буром. Факт или вымысел?
ТЭЦ, работающие на каменном угле более экологичны, чем на буром. Факт или вымысел? Химическая лаборатория
Химическая лаборатория Способы получения металлов
Способы получения металлов Презентация на тему Характеристика элементов VII группы главной подгруппы. Хлор
Презентация на тему Характеристика элементов VII группы главной подгруппы. Хлор  Пуриновые основания
Пуриновые основания Органическая химия. Введение
Органическая химия. Введение Нефть. Свойства нефти
Нефть. Свойства нефти Минералы. Лекция 02
Минералы. Лекция 02 Электролиз
Электролиз Теоретические основы метода потенциалов самопроизвольной поляризации - ПС
Теоретические основы метода потенциалов самопроизвольной поляризации - ПС Основные понятия физической химии
Основные понятия физической химии Органическая химия. Органические вещества
Органическая химия. Органические вещества Опыт разработки учебно-методического комплекса Химия
Опыт разработки учебно-методического комплекса Химия Легкоплавкие сплавы. Изменение свойств сплавов на технологических этапах. Адгезия
Легкоплавкие сплавы. Изменение свойств сплавов на технологических этапах. Адгезия Клей
Клей Окислительновосстановительные реакции в z природе и жизни человека
Окислительновосстановительные реакции в z природе и жизни человека Презентация на тему Химия в разных науках
Презентация на тему Химия в разных науках  Альдегиды и кетоны (часть 2)
Альдегиды и кетоны (часть 2) Соединения щелочноземельных металлов
Соединения щелочноземельных металлов Пересчет данных анализа, выраженных в ионной форме
Пересчет данных анализа, выраженных в ионной форме Материаловедение. Адсорбционные материалы. Металлоорганические каркасы
Материаловедение. Адсорбционные материалы. Металлоорганические каркасы Физические свойства алкенов
Физические свойства алкенов Атом- сложная частица
Атом- сложная частица Урок по теме Алюминий .Строение.Свойства. Учитель: Деревянко Н.Г.
Урок по теме Алюминий .Строение.Свойства. Учитель: Деревянко Н.Г.