Слайд 3Результаты экзамена в 2011 г
Калинина Екатерина -74 балла

Слайд 4Результаты экзамена в 2012 г
Ямщикова Екатерина – 50 баллов
Афанасьев Александр – 52

балла
Куцапкина Валентина – 54 балла
Созинов Павел – 66 баллов
Иванова Екатерина – 67 баллов
Лукьянов Станислав – 69 баллов
Средний балл- 59,5
Слайд 5Результаты по блокам:
Блок А (нет ошибок-Созинов П., 1 ошибка- Лукьянов С., 2

ошибки –Иванова Е.)
Блок В (нет ошибок- Лукьянов С., 1 ошибка- Созинов П., 2 ошибки –Иванова Е.)
Блок С (Лукьянов С, Иванова Н., Созинов П., Куцапкина В., выполняли задания; остальные не приступали к выполнению
заданий )
Слайд 6Используемая литература
при подготовке к экзамену учащиеся использовали только один учебник-
О.С.Габриелян, И.Г.Остроумов:

Выпускной/вступительный экзамен
Химия.
(Материалы для подготовки к единому
государственному экзамену и
вступит. экзаменам)
Слайд 7Работа с блоком А
Знакомство с кодификатором
Краткая беседа по теме
Выдача готовых

конспектов для подготовки
Выполнение тренировочных тестов
В случае неудачного выполнения- возврат к теории
Периодическое повторение темы
Слайд 8Пример конспекта для подготовки
Тема « Алканы»
Строение (sp3-гибридизация, вал. угол 109 градусов,28 минут,

длина связи 0.154 нм,строение тетраэдрическое)
Физ.свойства (алканы с CH4 до C4H10 — газы; с C5H12 до C15H32 — жидкости; с C16H34 — твёрдые вещества.
Алканы — неполярные соединения и трудно поляризуемые. Они легче воды и в ней практически не растворяются. Не растворяются также в других растворителях с высокой полярностью. Жидкие алканы — хорошие растворители для многих органических веществ.
Метан и этан, а также высшие алканы не имеют запаха, но среди других легколетучих низших углеводородов встречаются соединения, обладающие слабым запахом.
Алканы — горючие вещества. Метан горит бесцветным пламенем.)
Слайд 9Получение алканов:
Выделение из природного сырья
Гидрирование алкенов
Щелочной гидролиз солей карбоновых кислот
Синтез Вюрца
Гидролиз

карбидов . Знать: Al4C3 + 12H2O -> 3CH4 + 4Al(OH3)
Изомерия:
Для алканов характерен самый простой вид изомерии — структурная изомерия.
Слайд 10Химические свойства:
Реакция замещения ( самая характерная) (Галогенирование на свету) (Нитрование- реакция Коновалова)
Дегидрирование

(получение ацетилена из метана, этилена из этана)
Окисление каталитичкеское (метан может окислиться в метанол, метаналь, метановую кислоту) , (окисление бутана приводит к образованию этановой кислоты)
Горение ( получается СО2 и Н2О )
Изомеризация
Ароматизация
Разложение
Крекинг
Конверсия метана в присутствии кат. (CH4 + H2O → CO + 3H2). Продукт этой реакции (смесь CO и H2) называется «синтез-газом».








 Расчеты по химическим уравнениям
Расчеты по химическим уравнениям Углерод и его свойства
Углерод и его свойства Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок
Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок Substanță chimică
Substanță chimică Устный журнал из истории развития химии
Устный журнал из истории развития химии Своя игра по химии
Своя игра по химии Презентация на тему Нитраты и организм человека
Презентация на тему Нитраты и организм человека 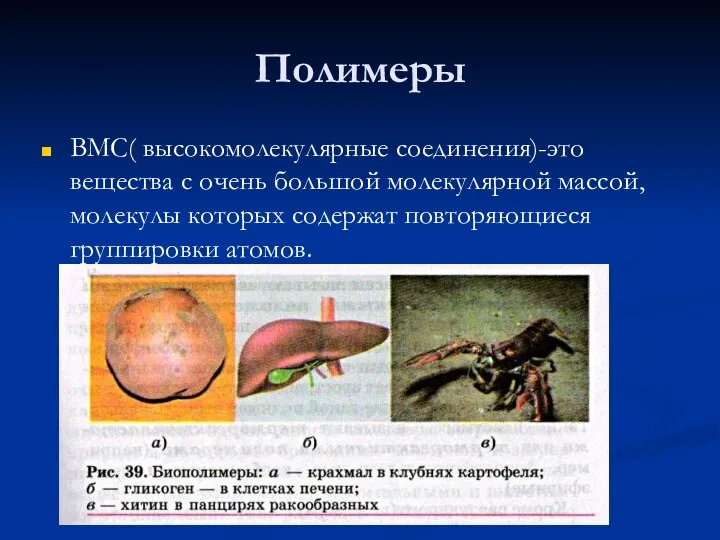 Полимеры
Полимеры Растворение веществ в воде. Лабораторный опыт № 5 Изучение растворимости веществ
Растворение веществ в воде. Лабораторный опыт № 5 Изучение растворимости веществ Технические материалы. Металлические и неметаллические. (Тема 1)
Технические материалы. Металлические и неметаллические. (Тема 1) Электролитическая диссоциация
Электролитическая диссоциация Презентация на тему Органическая химия "Жиры"
Презентация на тему Органическая химия "Жиры"  Реакционная способность органических соединений
Реакционная способность органических соединений Реакции обмена
Реакции обмена Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость
Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость Простые и сложные вещества
Простые и сложные вещества Алюминий. Из истории открытия
Алюминий. Из истории открытия Строение атома
Строение атома f8ea0c69dfd043588bd2a8735e944773
f8ea0c69dfd043588bd2a8735e944773 Продолжение классификации
Продолжение классификации Алюминий
Алюминий Химическая кинетика. Факторы, влияющие на скорость реакции
Химическая кинетика. Факторы, влияющие на скорость реакции Алкадиены. Строение. свойства и применение
Алкадиены. Строение. свойства и применение Презентация на тему Природные источники углеводородов
Презентация на тему Природные источники углеводородов  Подготовка к контрольной работе Неметаллы
Подготовка к контрольной работе Неметаллы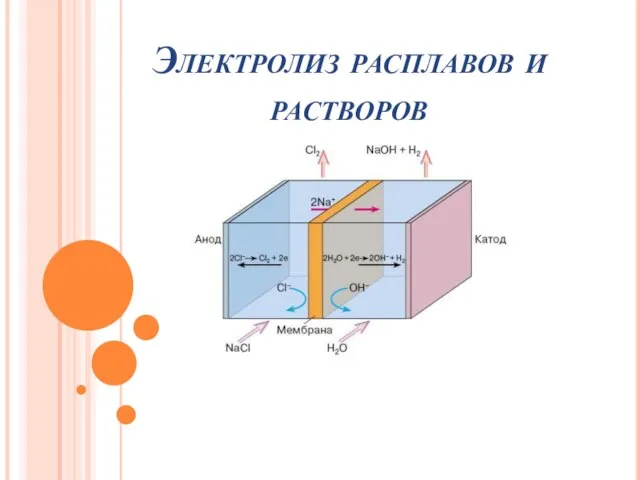 Электролиз расплавов растворов
Электролиз расплавов растворов Физическая химия, термодинамика
Физическая химия, термодинамика Физические и химические свойства алкенов
Физические и химические свойства алкенов