Слайд 2Ацетиленовые углеводороды
Ацетиленовыми углеводородами (алкинами) называются непредельные (ненасыщенные) углеводороды, содержащие в молекуле

одну тройную связь и имеющие общую формулу CnH2n-2.
Родоначальником гомологического ряда этих
углеводородов является ацетилен HC≡CH.
Слайд 3Номенклатура
Согласно международной номенклатуре названия
ацетиленовых углеводородов производят от
соответствующего алкана с заменой суффикса

–ан на –ин.
Главную цепь нумеруют с того конца, к которому
ближе расположена тройная связь.
Положение тройной связи обозначают номером того
атома углерода, который ближе к началу цепи.
1 2 3 4 5
CH3 – C ≡ C – CH(CH3) – CH3
4-метилпентин-2
Слайд 4Изомерия
1) изомерия углеродного скелета (начиная с C5H8)
CH≡C-CH2-CH2-CH3 CH≡C- CH(CH3)- CH3

пентин-1 3-метилбутин-1
2) изомерия положения тройной связи (начиная с C4H6)
CH≡C-CH2-CH2-CH3 CH3-C≡C-CH2-CH3
пентин-1 пентин-2
3) межклассовая изомерия (алкадиены).
CH≡C-CH2-CH2-CH3 CH2=CH-CH=CH-CH3
пентин-1 пентадиен-1,3
Слайд 5Физические свойства
Температуры их плавления и кипения
увеличиваются с ростом молекулярной массы.
В

обычных условиях алкины С2–С3 – газы, С4-С16
– жидкости, высшие алкины – твердые вещества.
Наличие тройной связи в цепи приводит к повышению
температуры кипения, плотности и растворимости их
в воде по сравнению с олефинами и парафинами.
Слайд 6Получение
1) В промышленноси ацетилен получают
высокотемпературным пиролизом метана.
1500ºС
2CH4 →
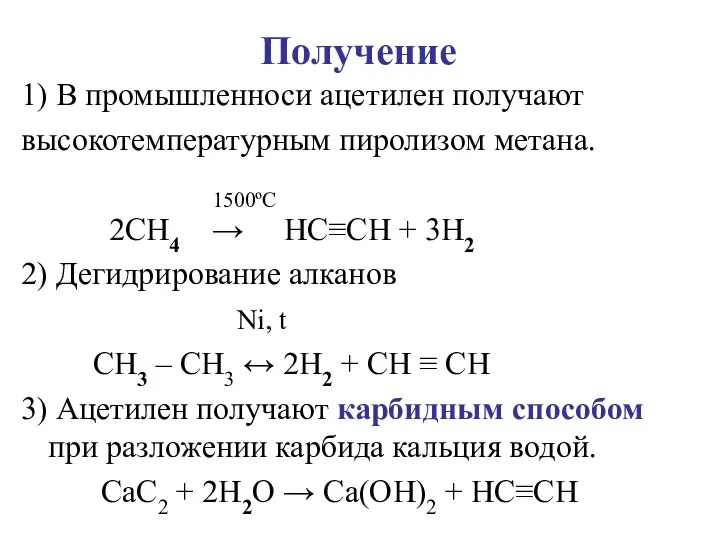
HC≡CH + 3H2
2) Дегидрирование алканов
Ni, t
CH3 – CH3 ↔ 2H2 + CH ≡ CH
3) Ацетилен получают карбидным способом при разложении карбида кальция водой.
CaC2 + 2H2O → Ca(OH)2 + HC≡CH
Слайд 74) Алкины можно получить
дегидрогалогенированием,
дигалогенопроизводных парафинов.
СH3–CH(Br)–CH2(Br) + 2 KOH→CH3–C≡CH +
+ 2KBr + 2H2O

спирт. р-р
CH3–C(Br2)–CH2–CH3+2KOH→CH3–C≡C–CH3+
+ 2KBr + 2H2O спирт. р-р
Слайд 8Химические свойства
Реакции присоединения
1) Гидрирование осуществляется при нагревании с теми же

металлическими катализаторами (Ni, Pd или Pt), что и в случае алкенов, но с меньшей скоростью.
CH3–C≡CH + H2 → CH3–CH=CH2
CH3–CH=CH2 + H2 → CH3–CH2–CH3
Слайд 9 2) Галогенирование. Алкины обесцвечивают бромную воду (качественная реакция на тройную связь).

Реакция галогенирования алкинов протекает медленнее, чем алкенов.
HC≡CH + Br2 → CHBr=CHBr
CHBr=CHBr + Br2 → CHBr2–CHBr2
3) Гидрогалогенирование. Образующиеся продукты определяются правилом Марковникова.
CH3–C≡CH + HBr → CH3–CBr=CH2
CH3–CBr=CH2 + HBr → CH3–CBr2–CH3
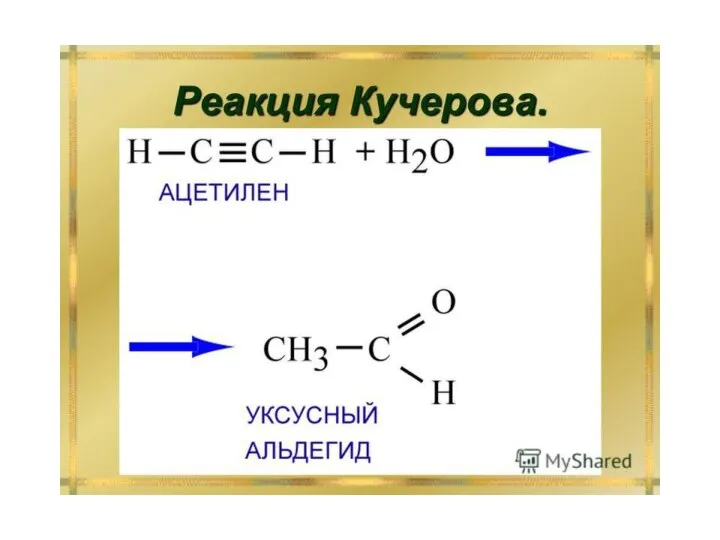
Слайд 10 4) Гидратация (реакция Кучерова). Присоединение воды осуществляется в присутствии сульфата ртути. Эту

реакцию открыл и исследовал в 1881 году М.Г.Кучеров.
HgSO4
C2H5–C≡CH + H2O → C2H5 – C – CH3
||
O
Слайд 12Правило В.В.Марковникова:
водород присоединяется к наиболее гидрогенизированному атому углерода при двойной связи,

то есть к атому углерода с наибольшим числом водородных атомов.










 Основания. Схема образования гидроксида натрия
Основания. Схема образования гидроксида натрия Алкан бутан (C4H10)
Алкан бутан (C4H10) Состав атома
Состав атома Классификация коррозионных процессов металлов
Классификация коррозионных процессов металлов Лекция1Тов
Лекция1Тов Адсорбция. Механизмы адсорбции. Термодинамика адсорбции. Лекция 5
Адсорбция. Механизмы адсорбции. Термодинамика адсорбции. Лекция 5 Валентность, классы и номенклатура неорганических веществ
Валентность, классы и номенклатура неорганических веществ Водные биоресурсы и аквакультура. Расчеты в объемном анализе
Водные биоресурсы и аквакультура. Расчеты в объемном анализе Основания
Основания тб в кабинете биологии [Автосохраненный]
тб в кабинете биологии [Автосохраненный] Основные понятия термодинамики.Первое начало термодинамики и его применимость к биосистемам. (Лекция 04)
Основные понятия термодинамики.Первое начало термодинамики и его применимость к биосистемам. (Лекция 04) Практическая работа №5. Качественные реакции на анионы 1-3 групп
Практическая работа №5. Качественные реакции на анионы 1-3 групп Марганец. Химия элементов. Кислородосодержащие соединения
Марганец. Химия элементов. Кислородосодержащие соединения Химия в нашей жизни
Химия в нашей жизни Избыток, недостаток. Решение задач
Избыток, недостаток. Решение задач Процессы минералообразования
Процессы минералообразования Закономерности изменения окислительно-востановительных свойств соединений в периодах и группах
Закономерности изменения окислительно-востановительных свойств соединений в периодах и группах Получение и применение аренов
Получение и применение аренов Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Лекция 6 Смазочные масла
Лекция 6 Смазочные масла Спирты. Тест
Спирты. Тест ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА АЛКИНОВ
ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА АЛКИНОВ Презентация на тему Химическая связь
Презентация на тему Химическая связь  Закалка и отпуск стали. Ознакомление со структурами серого и белого чугуна. Распознавание руд железа
Закалка и отпуск стали. Ознакомление со структурами серого и белого чугуна. Распознавание руд железа Сераорганические соединения
Сераорганические соединения Химическае препараты
Химическае препараты Срспальфа-олефинсульфанаттар
Срспальфа-олефинсульфанаттар Презентация по Химии "Строение и физические свойства металлов"
Презентация по Химии "Строение и физические свойства металлов"