Содержание
- 2. Правило суммарный заряд молекулы в ОВР равен нулю!!! Суммарный заряд в молекуле рассчитывается исходя из числа
- 3. Определение степеней окисления. Постоянные степени окисления: Степень окисления (далее С.О.) простого вещества = 0 ( Cu0
- 4. Последний элемент при написаний формулы неорганического вещества практически всегда имеет отрицательную степень окисления, которую можно определить
- 5. В бинарном соединении степень окисления веществ определяется следующим образом: Определяем атом с отрицательной С.О. (он написан
- 6. Если в соединении у одного атома четная, а у другого атома нечетная С.О., то так же
- 7. Если у двух атомов С.О. четная? Определяем С.О. отрицательно заряженного атома (она как правило меньше положительной)
- 8. Определение центрального атома в соединении из трех (и более элементов) Чтобы определить С.О. центрального атома необходимо
- 9. Если у первого элемента переходная степень окисления? В этом случае смотри на заряд АНИОНА (заряд аниона
- 10. Рассмотрим вариант, когда в сложном соединении есть скобки: Fe2(SO4)3 С.О. Fe =+3, так как число за
- 11. Правило в ОВР всегда повышаются и понижаются степени окисления!!! То есть есть окислитель (вещество понижающее С.О.)
- 12. Алгоритм расстановки коэффициентов методом электронного баланса: Расставляем степени окисления у всех элементов в уравнении; Если что-то
- 13. Пример расставления коэффициентов методом электронного баланса: Задание №20 используя метод электронного баланса, расставьте коэффициенты в уравнении
- 14. Расставляем все степени окисления: H+1I-1 + H2+1S+6O4-2 = I20 +H2+1S-2 + H2+1O-2
- 15. Составляем первоначальный баланс, чертим «решеточку»:
- 17. Скачать презентацию














 Массовая доля химического элемента
Массовая доля химического элемента Неметаллы
Неметаллы ЛКМ на основе кремнийорганических соединений
ЛКМ на основе кремнийорганических соединений Презентация на тему: Азотная кислота
Презентация на тему: Азотная кислота Алкины (ацетиленовые углеводороды)
Алкины (ацетиленовые углеводороды) Использование информационноко-ммуникационных технологий по формированию УУД на уроках химии
Использование информационноко-ммуникационных технологий по формированию УУД на уроках химии Решение экспериментальных задач по теме Металлы
Решение экспериментальных задач по теме Металлы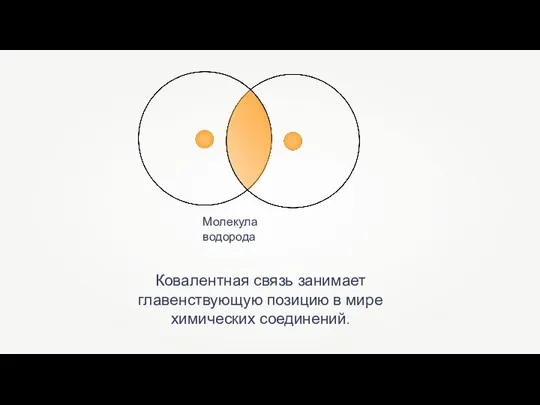 Ковалентная химическая связь
Ковалентная химическая связь Аминокислоты. Пептиды
Аминокислоты. Пептиды Закон Авогадро. Молярный объём газов
Закон Авогадро. Молярный объём газов Ароматические углеводороды. Бензол
Ароматические углеводороды. Бензол Сера
Сера Оксиды. 8 класс
Оксиды. 8 класс Классификация_органических_соединений[1]
Классификация_органических_соединений[1] Химия вокруг нас и для нас
Химия вокруг нас и для нас Ионная связь
Ионная связь Строение электронной оболочки атома часть 2
Строение электронной оболочки атома часть 2 Интеллектуальная игра по химии Металлы
Интеллектуальная игра по химии Металлы Ароматические углеводороды
Ароматические углеводороды Органическая химия
Органическая химия АТФ - аденозинтрифосфорная кислота
АТФ - аденозинтрифосфорная кислота Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения alkany_stroenie_nomenklatura_izomeriya_10_klass (3)-1
alkany_stroenie_nomenklatura_izomeriya_10_klass (3)-1 электролитическая диссоциация
электролитическая диссоциация Азотистые основания. Нуклеотиды и нуклеозиды. ДНК и РНК
Азотистые основания. Нуклеотиды и нуклеозиды. ДНК и РНК Изомерия. Упрощенная классификация органических соединений
Изомерия. Упрощенная классификация органических соединений Лакокрасочные материалы
Лакокрасочные материалы Окислительно-восстаовительные реакции
Окислительно-восстаовительные реакции