Слайд 3Пирометаллургия
Получение меди из его оксида с помощью восстановителя водорода

Слайд 4Пирометаллургия
Получение меди из его оксида с помощью восстановителя водорода
CuO + H2 →

Cu + H2O
Слайд 5Пирометаллургия
Получение свинца из его оксида с помощью восстановителя угля

Слайд 6Пирометаллургия
Получение свинца из его оксида с помощью восстановителя угля
PbO + C

→ Pb + CO
Слайд 7Пирометаллургия
Получение хрома алюмотермией

Слайд 8Пирометаллургия
Получение хрома алюмотермией
Cr2O3 + 2AI → 2Cr + AI2O3

Слайд 92. Гидрометаллургия
Например, для получения меди из руды, содержащей оксид меди (II) CuO:

СuO + H2SO4 = CuSO4 + H2O CuSO4 + Fe = FeSO4 + Cu
Таким же способом получают серебро, цинк, молибден, золото, уран и т. д.
Слайд 103. Электрометаллургия
Это способы получения металлов с помощью электрического тока (электролиза).

Слайд 11«Катод» - отрицательно заряженный электрод, на котором происходит процесс восстановления.
«Анод» - положительно

заряженный электрод, на котором происходит процесс восстановления.
«Катионы» - положительно заряженные ионы.
«Анионы» - отрицательно заряженные ионы.
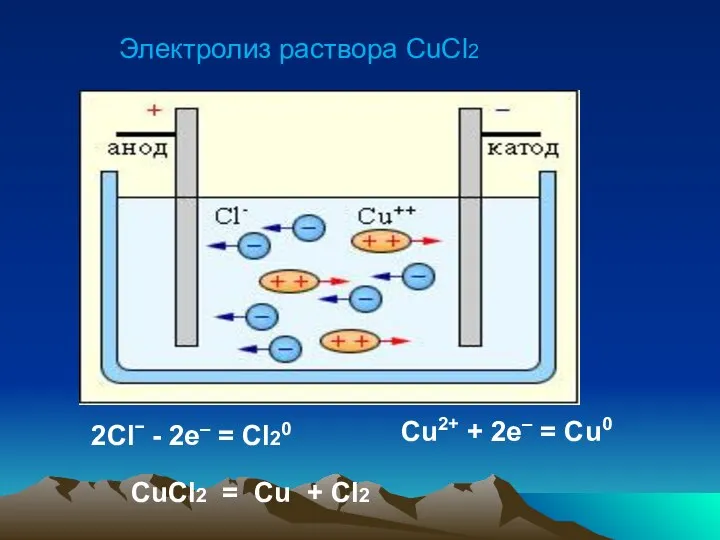
Слайд 13Электролиз раствора
хлорида меди (II)

Слайд 14Электролиз раствора CuCl2
2Clˉ - 2e– = Cl20
Cu2+ + 2e– = Cu0












 Ионная химическая связь
Ионная химическая связь Применение алканов
Применение алканов Получение и химические свойства оксидов
Получение и химические свойства оксидов Элементы vi группы главной подгруппы. Халькогены (рождающие руды)
Элементы vi группы главной подгруппы. Халькогены (рождающие руды) Презентация на тему Полимеры
Презентация на тему Полимеры  Аминокилоты. Получение и применение
Аминокилоты. Получение и применение Действие активированного угля
Действие активированного угля Альдегиды, гомология, изомерия, номенклатура
Альдегиды, гомология, изомерия, номенклатура Презентация на тему Типы химических реакций (8 класс)
Презентация на тему Типы химических реакций (8 класс)  Хімічні формули
Хімічні формули Для чего нужна нефть
Для чего нужна нефть Кристаллы, выращенные учащимися
Кристаллы, выращенные учащимися Азотистые основания. Нуклеозиды. Нуклеотиды. Нуклеиновые кислоты. Лекция 7
Азотистые основания. Нуклеозиды. Нуклеотиды. Нуклеиновые кислоты. Лекция 7 Возможные роли АФК в старении
Возможные роли АФК в старении Svins. Iegūšana
Svins. Iegūšana Алкены. Строение, номенклатура, изомерия, физические свойства
Алкены. Строение, номенклатура, изомерия, физические свойства Металлическая химическая связь
Металлическая химическая связь Современные представления о механизме реакций отщепления. Спектр механизмов E1-E2-E1cB. Диаграммы Дженкса-О’Феррола
Современные представления о механизме реакций отщепления. Спектр механизмов E1-E2-E1cB. Диаграммы Дженкса-О’Феррола Применение алкенов
Применение алкенов Чистые вещества и смеси
Чистые вещества и смеси Янтарь
Янтарь Электролитическая диссоциация
Электролитическая диссоциация Соли: получение
Соли: получение Жиры. 10 класс
Жиры. 10 класс Транспорт веществ
Транспорт веществ анлекция 3
анлекция 3 Презентация на тему Теория строения химических соединений А.М.Бутлерова
Презентация на тему Теория строения химических соединений А.М.Бутлерова  Кислород
Кислород