Содержание
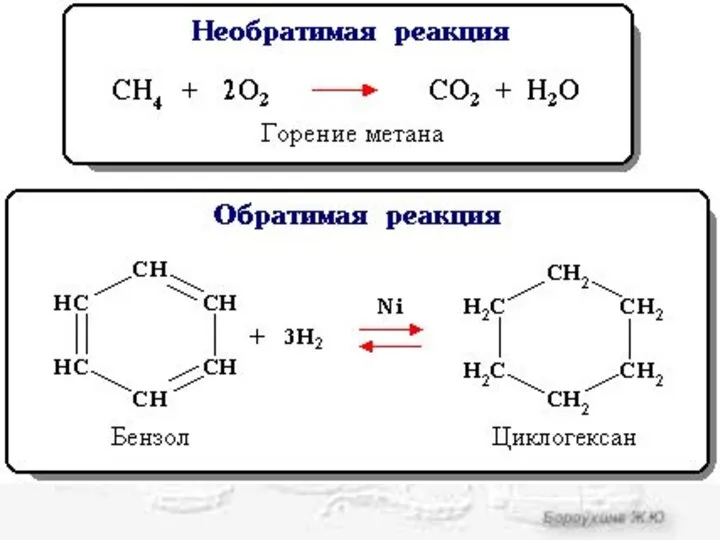
- 2. Химическое равновесие Состояние равновесия характерно для обратимых химических реакций. Обратимая реакция - химическая реакция, которая при
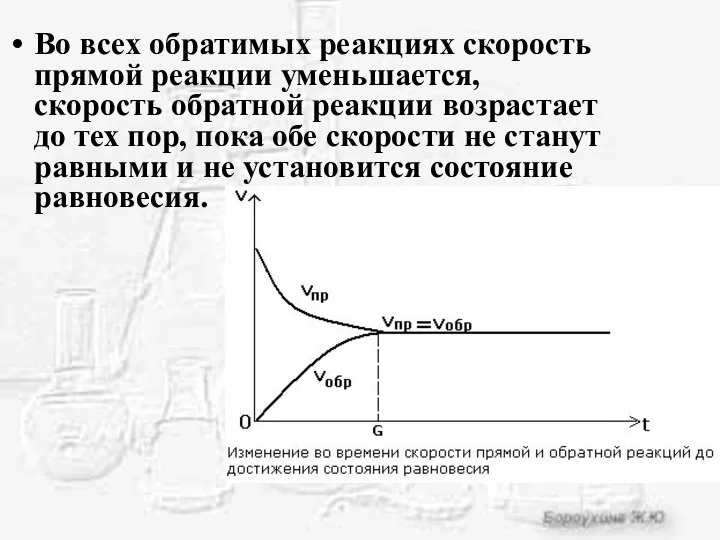
- 4. Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока
- 5. Химическое равновесие - состояние системы, в котором скорость прямой реакции равна скорости обратной реакции.
- 6. Концентрации всех веществ в состоянии равновесия (равновесные концентрации) постоянны. Химическое равновесие имеет динамический характер. Это значит,
- 7. Смещение равновесия в нужном направлении достигается изменением условий реакции (принцип Ле-Шателье). Принцип Ле-Шателье -Если на систему,находящуюся
- 8. Для одностадийной обратимой реакции при равновесии выражения для скоростей прямой V1 и обратной реакций V2 имеют
- 9. Из условия равновесия V1=V2 следует: Отсюда получаем выражение для константы равновесия Kp: Чем выше величина Kp,
- 10. Влияние температуры на смещение равновесия Реакции, сопровождающиеся выделением теплоты, называются экзотермическими. Реакции, сопровождающиеся поглощением теплоты, называются
- 11. Влияние температуры на смещение равновесия Чтобы сместить равновесие вправо (для экзотермической реакции)---нужно понизить температуру. А для
- 12. При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры - в направлении
- 13. Влияние концентрации на смещение равновесия Равновесие сместится ВПРАВО, если: Увеличить концентрацию одного из реагирующих веществ Отводить
- 14. Влияние давления на смещение равновесия Влияние давления на состояние равновесия проявляется только при наличии в системе
- 15. Влияние давления на смещение равновесия При повышении давления равновесие сдвигается в направлении образования веществ (исходных или
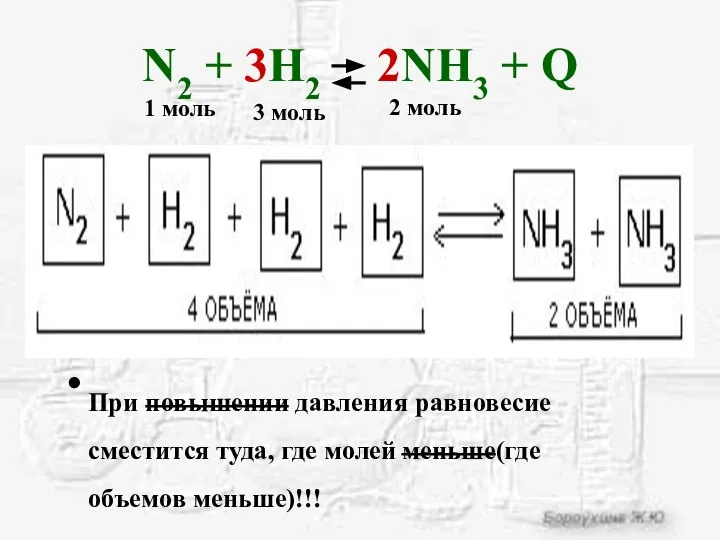
- 16. N2 + 3H2 2NH3 + Q При повышении давления равновесие сместится туда, где молей меньше(где объемов
- 17. Катализаторы не влияют на положение равновесия!
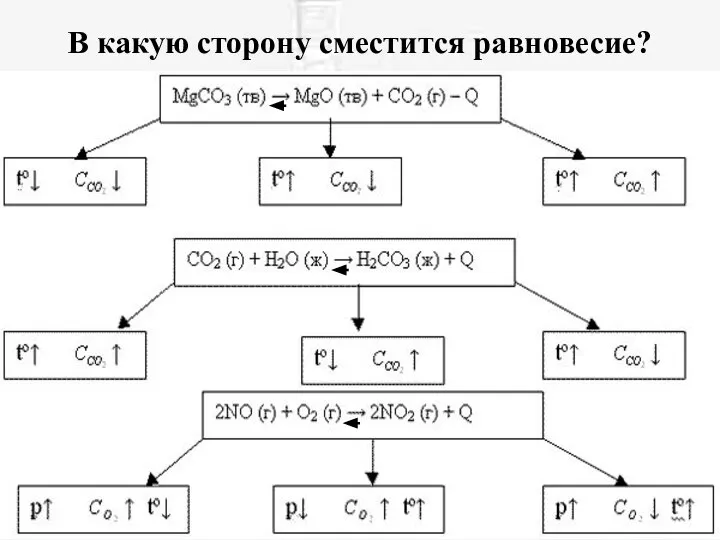
- 18. В какую сторону сместится равновесие?
- 20. Скачать презентацию













 Научные принципы химического производства
Научные принципы химического производства Лаборатория мечты
Лаборатория мечты Введение в общую теорию поверхностных явлений. Лекция 1
Введение в общую теорию поверхностных явлений. Лекция 1 3 Серная кислота
3 Серная кислота Презентация на тему Классификация кислот
Презентация на тему Классификация кислот  Технологические процессы получения кислорода
Технологические процессы получения кислорода Строение вещества. Виды химической связи
Строение вещества. Виды химической связи Алканы 10-класс
Алканы 10-класс Способы получения металлов
Способы получения металлов Карбонаты. Лекция 12
Карбонаты. Лекция 12 Органическая химия. Центр дистанционного обучения
Органическая химия. Центр дистанционного обучения Взаимодействие элементов-неметаллов между собой. 8 класс
Взаимодействие элементов-неметаллов между собой. 8 класс Понятие электродного потенциала и методы его измерения
Понятие электродного потенциала и методы его измерения Полиморфизм. Аллотропия
Полиморфизм. Аллотропия Сода. Что я знаю о ней!?
Сода. Что я знаю о ней!? Неорганические молекулы живого вещества: вода; химические свойства и биологическая роль
Неорганические молекулы живого вещества: вода; химические свойства и биологическая роль Скорость химической реакции
Скорость химической реакции Масляная кислота
Масляная кислота Презентация 3. Теория ЕГЭ
Презентация 3. Теория ЕГЭ Химия металлов. Влияние металлов на организм человека
Химия металлов. Влияние металлов на организм человека Происхождения названий химических элементов
Происхождения названий химических элементов Металлы. Контрольная работа
Металлы. Контрольная работа Неорганическая и органическая химия
Неорганическая и органическая химия Растворы. Лекция 7
Растворы. Лекция 7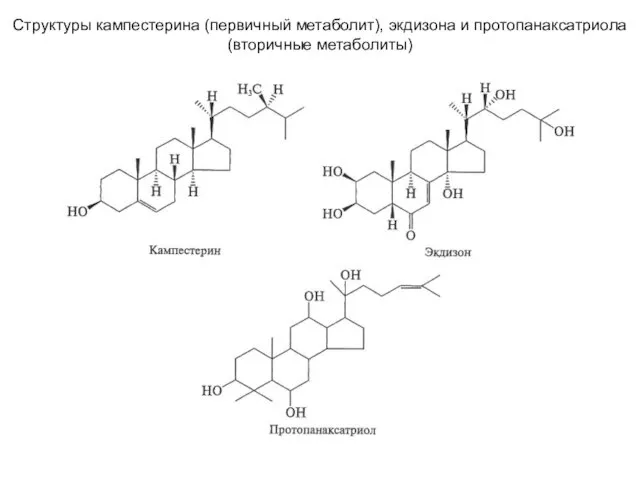 Структуры кампестерина (первичный метаболит), экдизона и протопанаксатриола (вторичные метаболиты)
Структуры кампестерина (первичный метаболит), экдизона и протопанаксатриола (вторичные метаболиты) Коррозия металлов
Коррозия металлов Химия функциональных материалов. Адсорбция
Химия функциональных материалов. Адсорбция Чистые вещества и смеси
Чистые вещества и смеси