Содержание
- 2. Соли - сложные вещества, состоящие из атомов металлов (иногда входит водород или гидроксильная группа) и кислотных
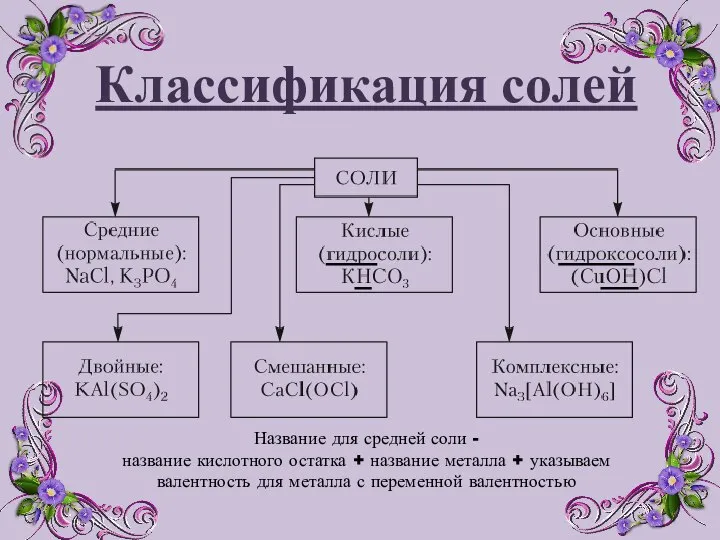
- 3. Классификация солей Название для средней соли - название кислотного остатка + название металла + указываем валентность
- 4. Получение солей 1. Из металлов: металл + неметалл = соль Приведите пример металл (до Н2) +
- 5. 2.Из оксидов: кислотный оксид + щелочь = соль + вода Приведите пример основный оксид + кислота
- 6. 3. Реакция нейтрализации: кислота + основание = соль + вода Приведите пример 4. Из солей: соль1
- 7. ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ №1. Дайте названия следующим солям: NaCl KNO3 FeCl3 Li2SO4 KHSO4 BaOHCl CaSO3 Al2S3
- 8. №2. Составьте химические формулы солей по их названиям: хлорид железа (II), гидросульфид калия, сульфид калия, сульфит
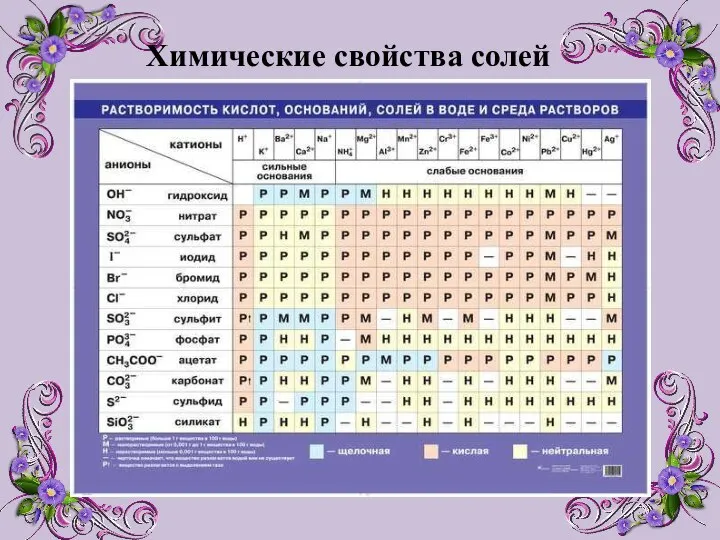
- 9. Химические свойства солей
- 10. Химические свойства солей 1) Разложение при нагревании. При нагревании некоторых солей они разлагаются на оксид металла
- 11. 2) Взаимодействие с кислотами: реакция происходит, если соль образована более слабой или летучей кислотой, или если
- 12. 3) Взаимодействие со щелочами. Со щелочами реагируют соли, если при этом образуется нерастворимое основание. CuSO4 +
- 14. Скачать презентацию









 Изучение зависимости скорости химической реакции от различных факторов. Практическая работа № 6
Изучение зависимости скорости химической реакции от различных факторов. Практическая работа № 6 Исследовательская работа по химии на тему: Интегративные проблемные ситуации
Исследовательская работа по химии на тему: Интегративные проблемные ситуации Тест по теме Альдегиды и кетоны
Тест по теме Альдегиды и кетоны Материаловедение. Модуль
Материаловедение. Модуль Синтез оксида меди и йодида меди для формирования буферных слоев для ГОНП
Синтез оксида меди и йодида меди для формирования буферных слоев для ГОНП Обобщение и систематизация знаний по теме Вещества и их классификация
Обобщение и систематизация знаний по теме Вещества и их классификация Металлы
Металлы lektsia_6 (1)
lektsia_6 (1) Изучение возможности синтеза порошка сложного карбонитрида -титана молибдена Ti-Mo в режиме СВС
Изучение возможности синтеза порошка сложного карбонитрида -титана молибдена Ti-Mo в режиме СВС Development of the system of concepts on the topic redox reactions in the school course of inorganic chemistry
Development of the system of concepts on the topic redox reactions in the school course of inorganic chemistry Кристаллы
Кристаллы Электродные процессы. Электроды. Потенциометрия
Электродные процессы. Электроды. Потенциометрия Клеящие материалы
Клеящие материалы Алкены
Алкены Презентация на тему Арены (10 класс)
Презентация на тему Арены (10 класс)  Химия элементов VIA группы
Химия элементов VIA группы Радон (222Rn)
Радон (222Rn) Основные классы неорганических соединений. Мы едем, едем, едем…
Основные классы неорганических соединений. Мы едем, едем, едем… Практические занятия по теме: Методы защиты энергооборудования от коррозии (1)
Практические занятия по теме: Методы защиты энергооборудования от коррозии (1) Оксид серы (VI) SO3
Оксид серы (VI) SO3 Реакции
Реакции Химическая картина мира
Химическая картина мира valentnost
valentnost Reactivi444
Reactivi444 Тест по теме Основные классы неорганических соединений
Тест по теме Основные классы неорганических соединений Классы неорганических соединений Подготовка к ЕГЭ
Классы неорганических соединений Подготовка к ЕГЭ Получение и примененипе радиоактивные изотопы
Получение и примененипе радиоактивные изотопы Презентация на тему Химическая промышленность мира
Презентация на тему Химическая промышленность мира