Содержание
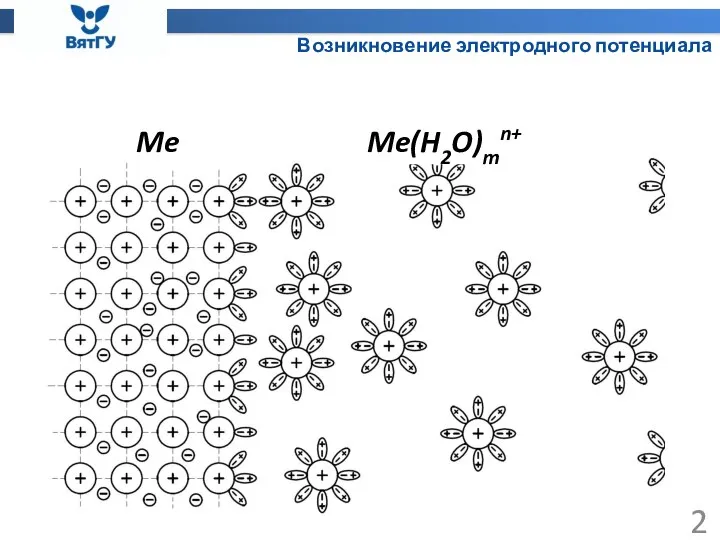
- 2. Возникновение электродного потенциала Me Me(H2O)mn+
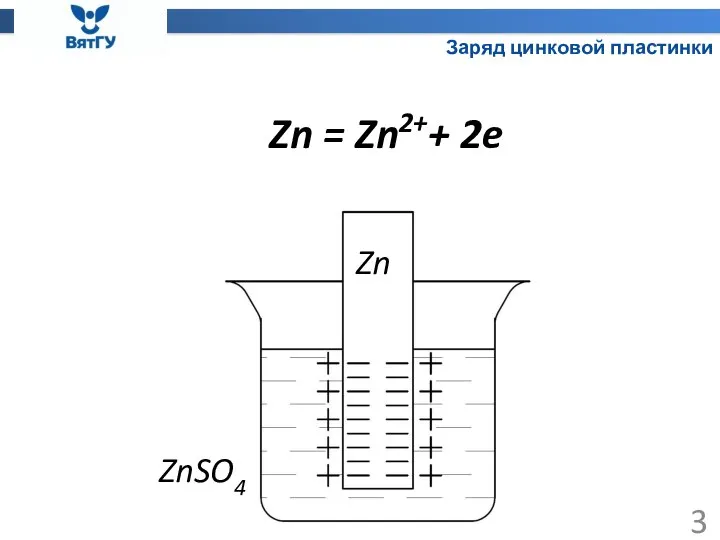
- 3. Заряд цинковой пластинки Zn ZnSO4 Zn = Zn2++ 2e
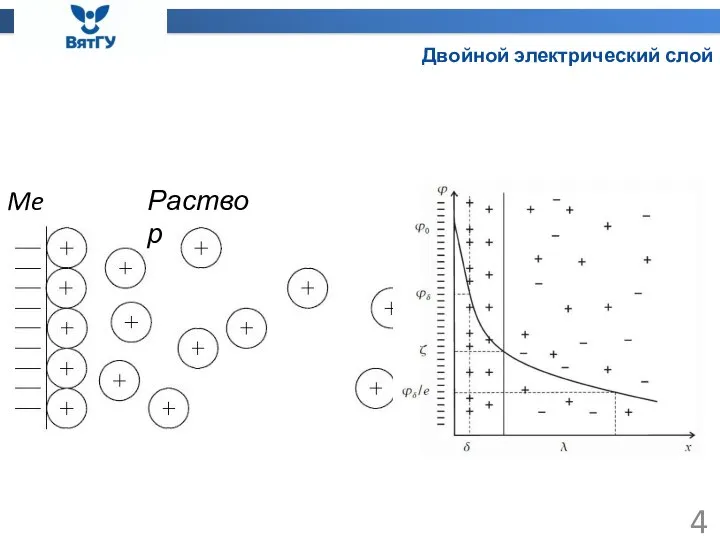
- 4. Двойной электрический слой Me Раствор
- 5. Уравнение Нернста
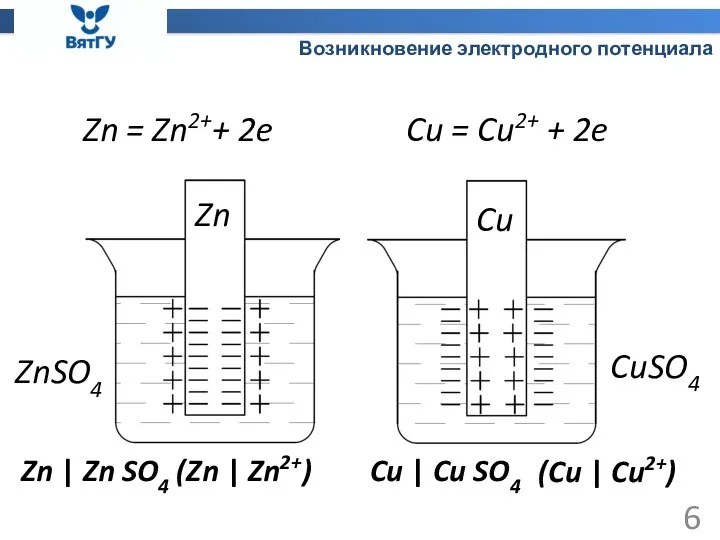
- 6. Возникновение электродного потенциала Zn = Zn2++ 2e Cu = Cu2+ + 2e Zn Cu ZnSO4 CuSO4
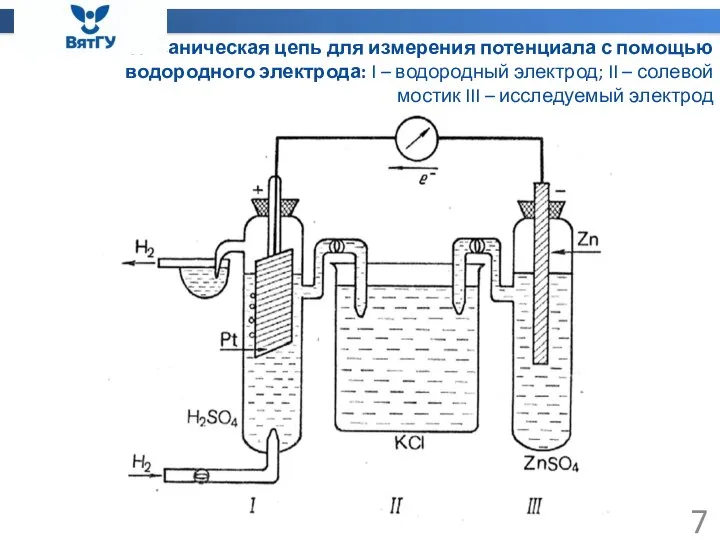
- 7. Гальваническая цепь для измерения потенциала с помощью водородного электрода: I – водородный электрод; II – солевой
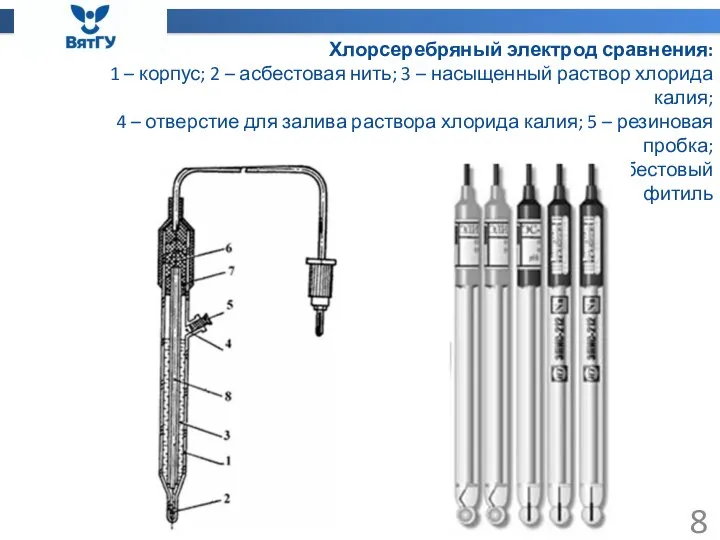
- 8. Хлорсеребряный электрод сравнения: 1 – корпус; 2 – асбестовая нить; 3 – насыщенный раствор хлорида калия;
- 9. Причины неравенства напряжения гальванического элемента с его ЭДС - Изменение потенциала электрода при протекании измерительного тока
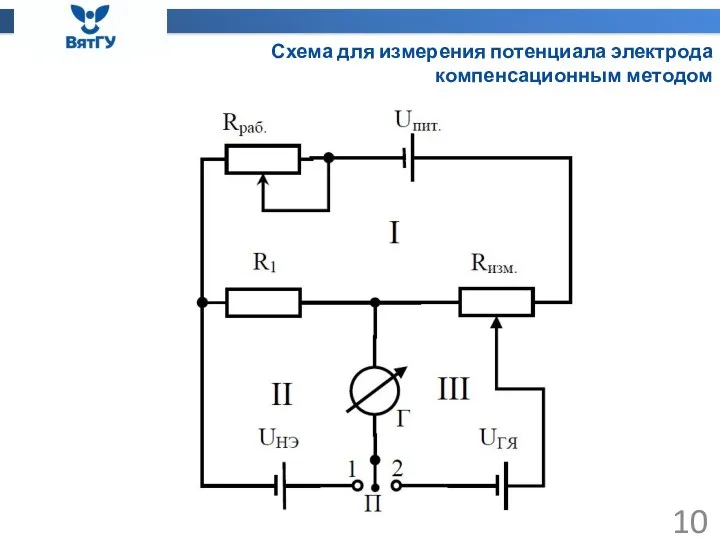
- 10. Схема для измерения потенциала электрода компенсационным методом
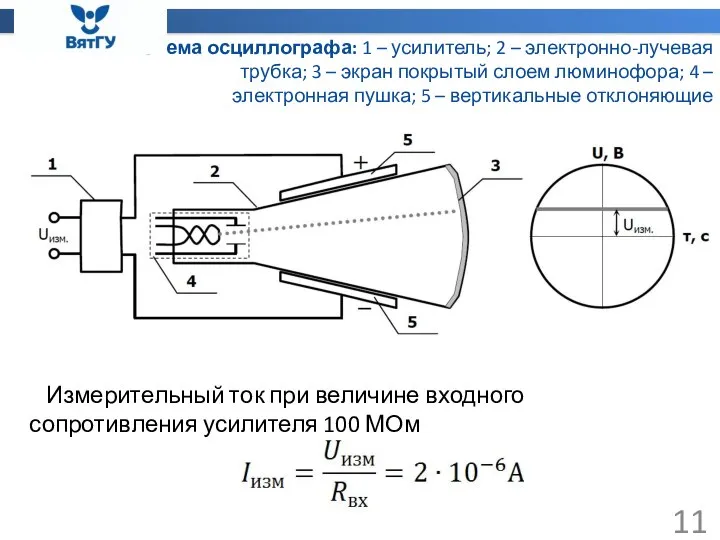
- 11. Схема осциллографа: 1 – усилитель; 2 – электронно-лучевая трубка; 3 – экран покрытый слоем люминофора; 4
- 12. Закон Фарадея
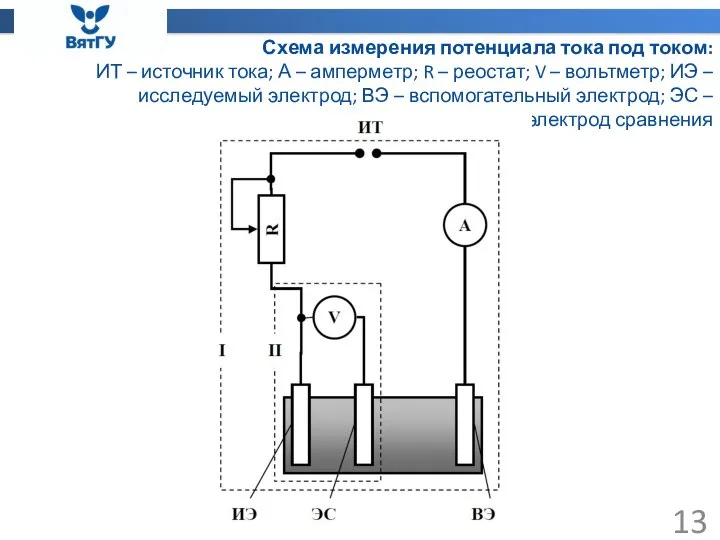
- 13. Схема измерения потенциала тока под током: ИТ – источник тока; А – амперметр; R – реостат;
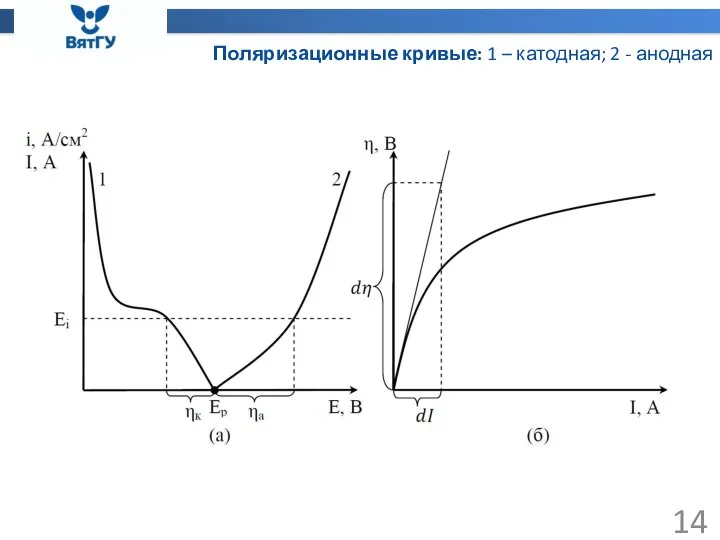
- 14. Поляризационные кривые: 1 – катодная; 2 - анодная
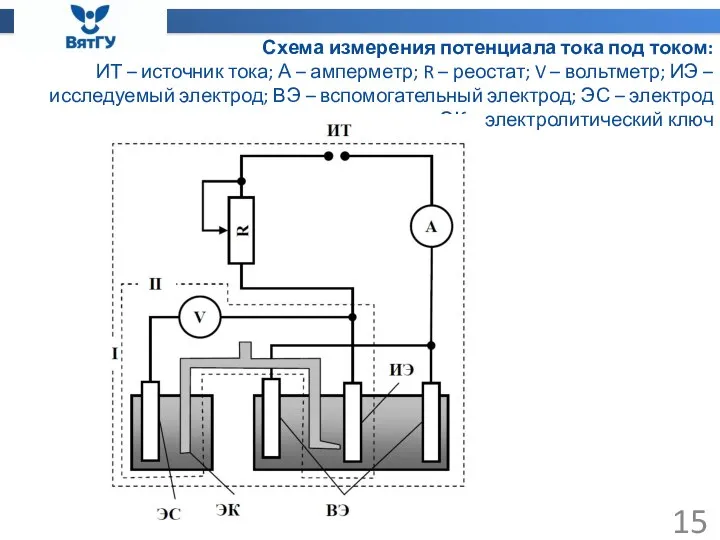
- 15. Схема измерения потенциала тока под током: ИТ – источник тока; А – амперметр; R – реостат;
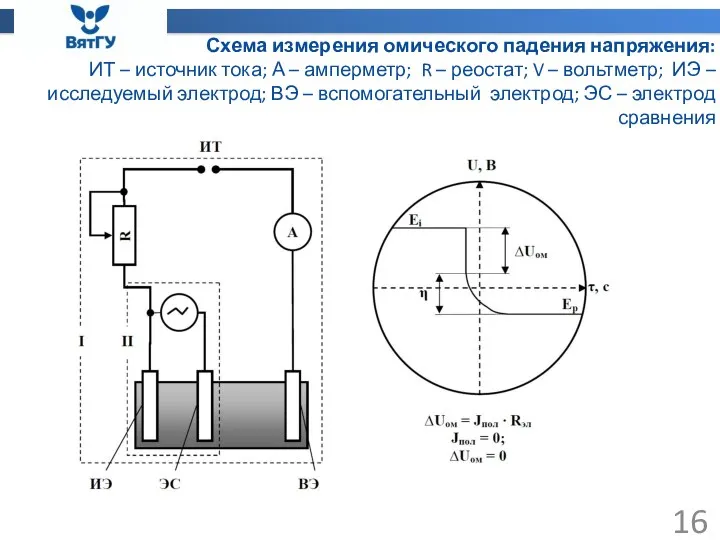
- 16. Схема измерения омического падения напряжения: ИТ – источник тока; А – амперметр; R – реостат; V
- 18. Скачать презентацию



 Химическое равновесие. Задачи
Химическое равновесие. Задачи Алканы
Алканы Автомобильные бензины. Свойства топлив
Автомобильные бензины. Свойства топлив Пиримидин. Пиримидиновые основания
Пиримидин. Пиримидиновые основания Возможности модернизации совместного производства фенола и ацетона кумольным способом
Возможности модернизации совместного производства фенола и ацетона кумольным способом Строение и свойства металлов
Строение и свойства металлов Презентация на тему Соединения серы
Презентация на тему Соединения серы  10_KISLOTNO_OSNOVNOE_TITROVANIE
10_KISLOTNO_OSNOVNOE_TITROVANIE Природные источники углеводородов. Природный и попутный нефтяные газы. Нефть. Каменный уголь
Природные источники углеводородов. Природный и попутный нефтяные газы. Нефть. Каменный уголь Соли. Классификация сложных веществ
Соли. Классификация сложных веществ Игра Что? Где? Когда?. Химия
Игра Что? Где? Когда?. Химия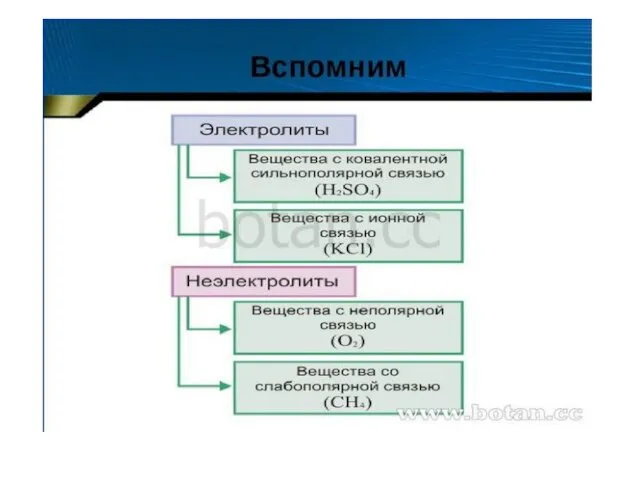 Диссоциация веществ
Диссоциация веществ Квантовая химия
Квантовая химия Классификация нефтей. Основы переработки нефти и нефтепродуктов
Классификация нефтей. Основы переработки нефти и нефтепродуктов Основные понятия химической термодинамики
Основные понятия химической термодинамики Уровень С1 в ГИА
Уровень С1 в ГИА Производство препарата Салициловая кислота, раствор для наружного применения спиртовой 2-х процентный
Производство препарата Салициловая кислота, раствор для наружного применения спиртовой 2-х процентный Энергетика химических реакций
Энергетика химических реакций Изучение пенопласта
Изучение пенопласта Презентация на тему Соли угольной кислоты
Презентация на тему Соли угольной кислоты  Степень окисления
Степень окисления Кислород
Кислород Сера
Сера Полимеры. Функции полимеров
Полимеры. Функции полимеров Электролиз расплавов и растворов солей
Электролиз расплавов и растворов солей Простые вещества – неметаллы. Аллотропия
Простые вещества – неметаллы. Аллотропия Изомерия. Виды изомерии
Изомерия. Виды изомерии Презентация на тему Щелочные металлы
Презентация на тему Щелочные металлы