Содержание
- 2. Какие газовые законы вам известны из курса физики?
- 3. Газовые законы Газовые законы определяют количественные зависимости между двумя параметрами газа при неизменном значении третьего. Газовые
- 4. Уравнение Клапейрона Объединенный газовый закон (уравнение Клапейрона): произведение давления данной массы на его объем, деленое на
- 5. Газовые законы Бойля - Мариотта Гей- Люссака Шарля
- 6. Закон Бойля-Мариотта РОБЕРТ БОЙЛЬ ЭДМ МАРИОТТ Закон получен экспериментально в 1662 Р. Бойлем в 1676 Э.
- 7. Закон Бойля-Мариотта Для газа данной массы произведение давления газа на его объем постоянно, если температура газа
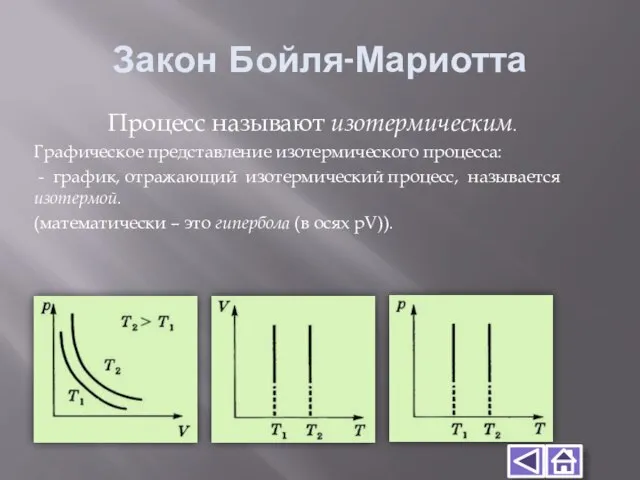
- 8. Закон Бойля-Мариотта Процесс называют изотермическим. Графическое представление изотермического процесса: - график, отражающий изотермический процесс, называется изотермой.
- 9. Закон Гей-Люссака Закон получен экспериментально в 1802г Жозе́ф Луи́ Гей-Люсса́к
- 10. Закон Гей-Люссака Для газа данной массы при постоянном давлении отношение объема к температуре постоянно. Или То
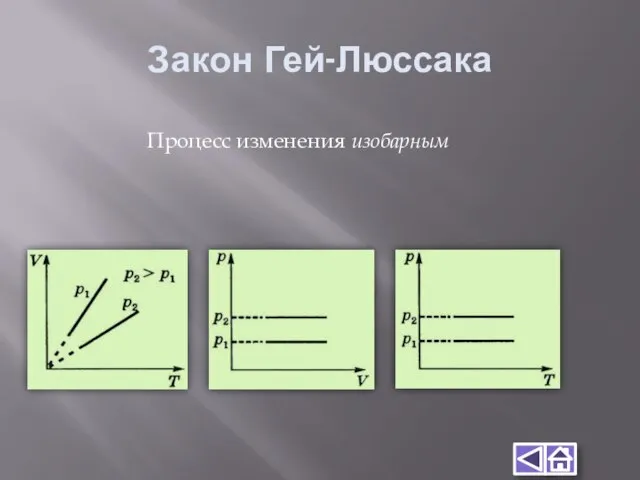
- 11. Закон Гей-Люссака Процесс изменения изобарным
- 12. Закон Шарля ЖАК АЛЕКСАНДР СЕЗАР ШАРЛЬ Установил закон экспериментально в 1787г.
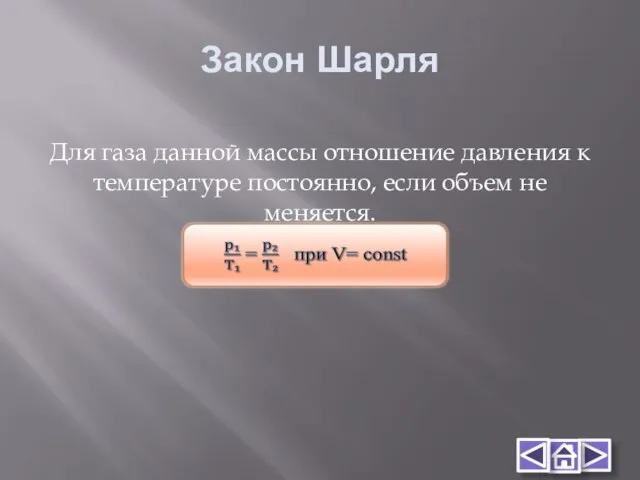
- 13. Закон Шарля Для газа данной массы отношение давления к температуре постоянно, если объем не меняется.
- 14. Закон Шарля Процесс изменения изохорным
- 15. Уравнение Менделеева -Клапейрона Состояние данной массы газа полностью определено, если известны его давление, температура и объем.
- 16. Газовые законы. Подводим итоги.
- 18. Скачать презентацию












 Практическая работа 1.Скорость химической реакции
Практическая работа 1.Скорость химической реакции Превращения веществ
Превращения веществ Строение вещества
Строение вещества Коррозия металлов, сплавов
Коррозия металлов, сплавов Ионная химическая связь
Ионная химическая связь Трёхкомпонентные системы. Лекция 25
Трёхкомпонентные системы. Лекция 25 Производство стекла
Производство стекла Серебро
Серебро Нуклеиновые кислоты
Нуклеиновые кислоты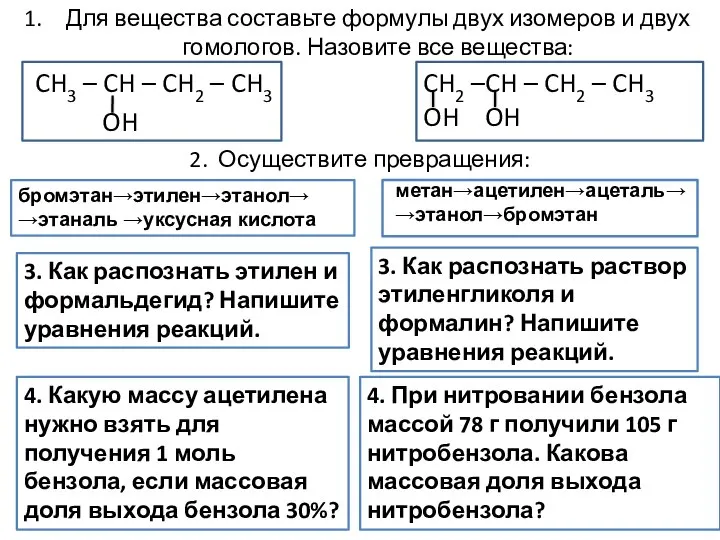 Формулы двух изомеров и двух гомологов
Формулы двух изомеров и двух гомологов Основания. 8 класс
Основания. 8 класс Аммиак: состав, строение, свойства, применение
Аммиак: состав, строение, свойства, применение Арены. Понятие ароматичности. Правило Хюкклея. Круг Фроста
Арены. Понятие ароматичности. Правило Хюкклея. Круг Фроста Углеводороды. Изомеры и гомологи
Углеводороды. Изомеры и гомологи Л-1 основные классы неорганических веществ
Л-1 основные классы неорганических веществ Хромофорная теория кислотно-основных индикаторов
Хромофорная теория кислотно-основных индикаторов Химический элемент кислород
Химический элемент кислород Приёмы работы с текстом на уроках химии
Приёмы работы с текстом на уроках химии Курсовая работа: синтез 3,5-диметилпиразола
Курсовая работа: синтез 3,5-диметилпиразола Небезпечні речовини
Небезпечні речовини Уретановый каучук
Уретановый каучук Эмульсия. Основные типы эмульсий
Эмульсия. Основные типы эмульсий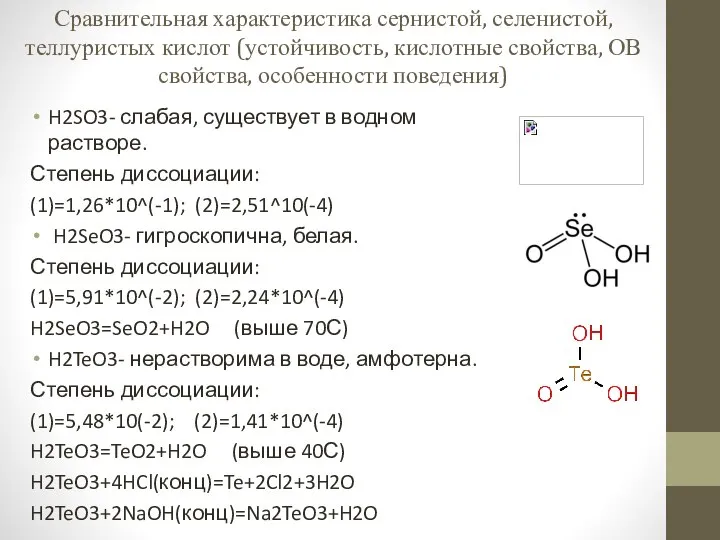 Сравнительная характеристика сернистой, селенистой, теллуристых кислот
Сравнительная характеристика сернистой, селенистой, теллуристых кислот Полимеры в медицине
Полимеры в медицине Строение атома
Строение атома анлекция 3
анлекция 3 Template biosynthesis
Template biosynthesis Гомологи и изомеры
Гомологи и изомеры