Содержание
- 2. В основу своей классификации химических элементов Д.И. Менделеев положил два их основных и постоянных признака: величину
- 3. При этом он обнаружил, что свойства элементов в некоторых пределах изменяются линейно (монотонно усиливаются или ослабевают),
- 4. На основании своих наблюдений 1 марта 1869 г. Д.И. Менделеев сформулировал периодический закон, который в начальной
- 5. Если написать ряды один под другим так, чтобы под литием находился натрий, а под неоном –
- 6. Периодический закон Д.И. Менделеева Современная трактовка Периодического закона: Свойства химических элементов и образуемых ими соединений находятся
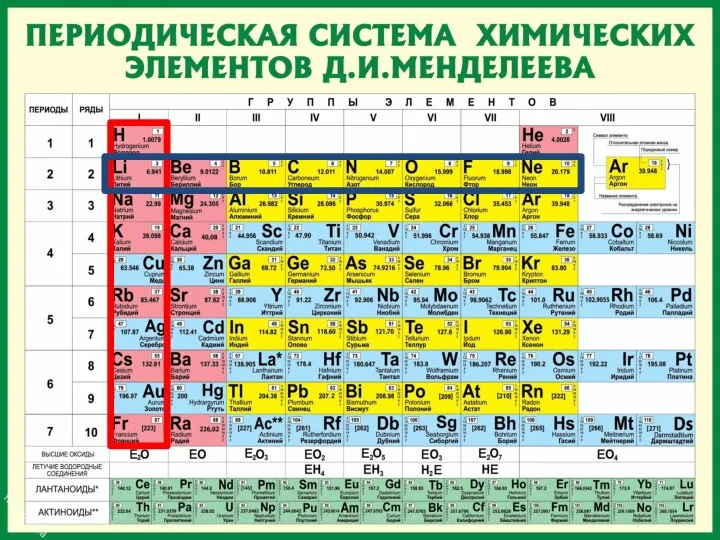
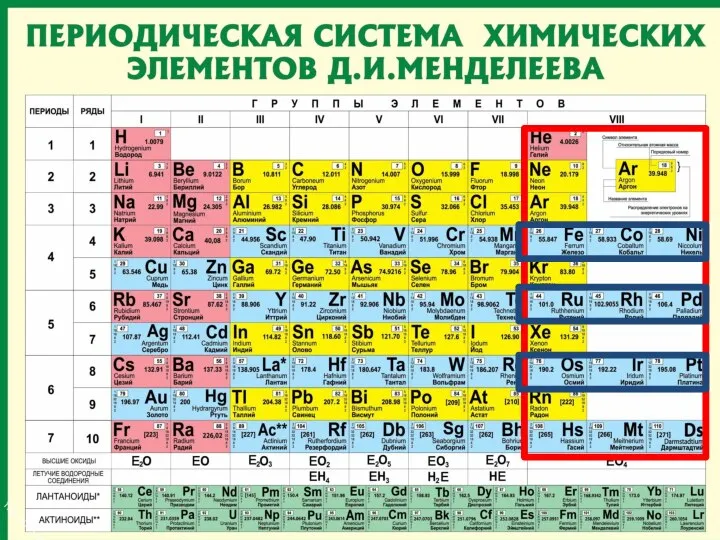
- 9. Периоды Периоды - горизонтальные ряды химических элементов, всего 7 периодов. Периоды делятся на малые (I,II,III) и
- 10. Каждый период (за исключением первого) начинается типичным металлом (Li, Nа, К, Rb, Cs, Fr) и заканчивается
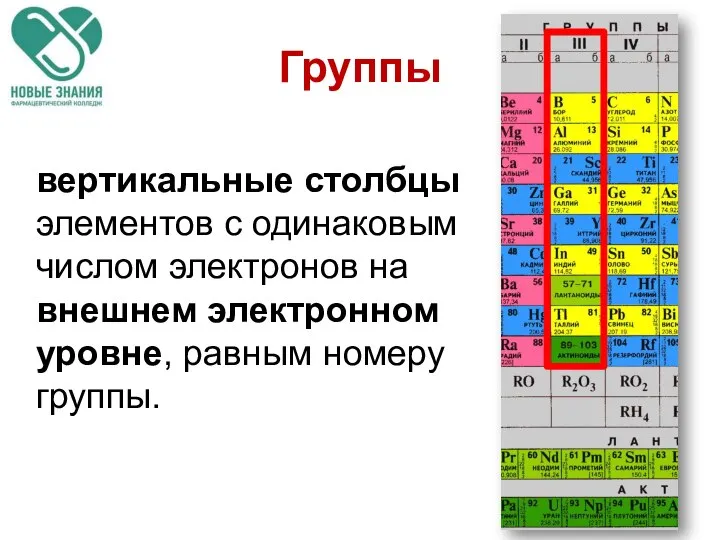
- 11. Группы вертикальные столбцы элементов с одинаковым числом электронов на внешнем электронном уровне, равным номеру группы.
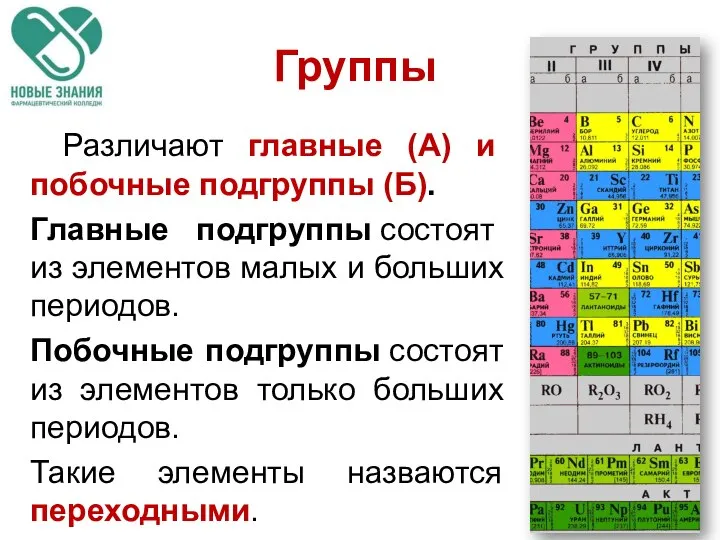
- 12. Различают главные (А) и побочные подгруппы (Б). Главные подгруппы состоят из элементов малых и больших периодов.
- 14. Периодическая таблица химических элементов Запомнить!!! Номер периода = число энергетических уровней атома. Номер группы = число
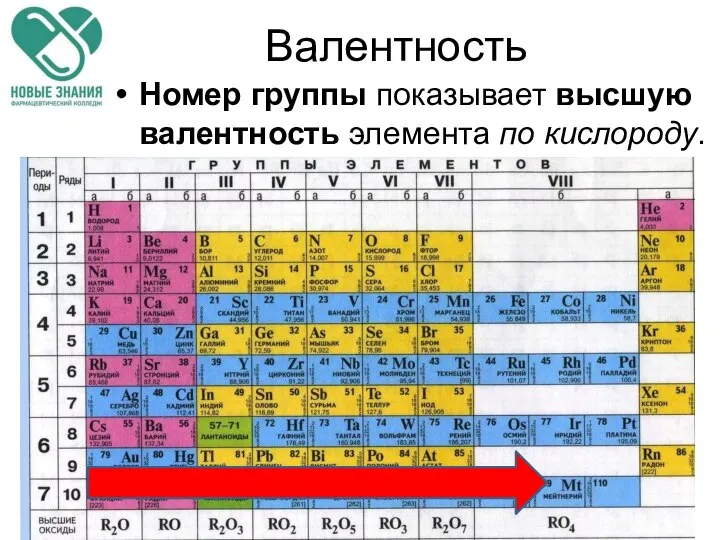
- 15. Валентность Номер группы показывает высшую валентность элемента по кислороду.
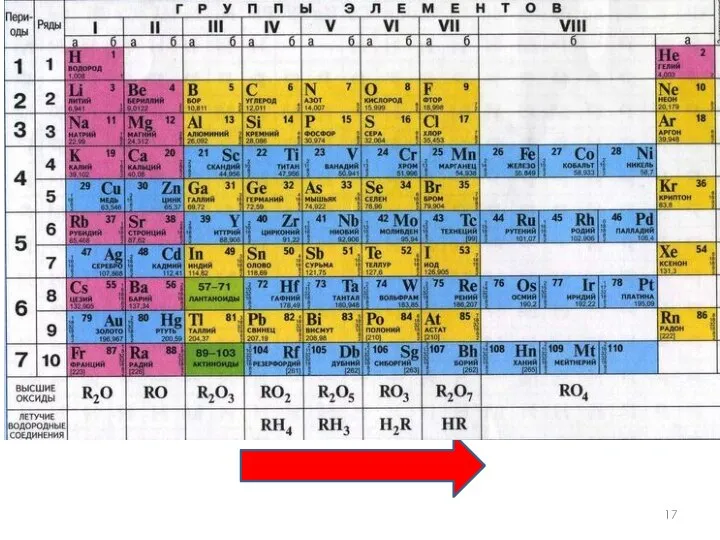
- 16. Валентность Элементы IV, V, VI и VII групп образуют летучие водородные соединения. Номер группы показывает валентность
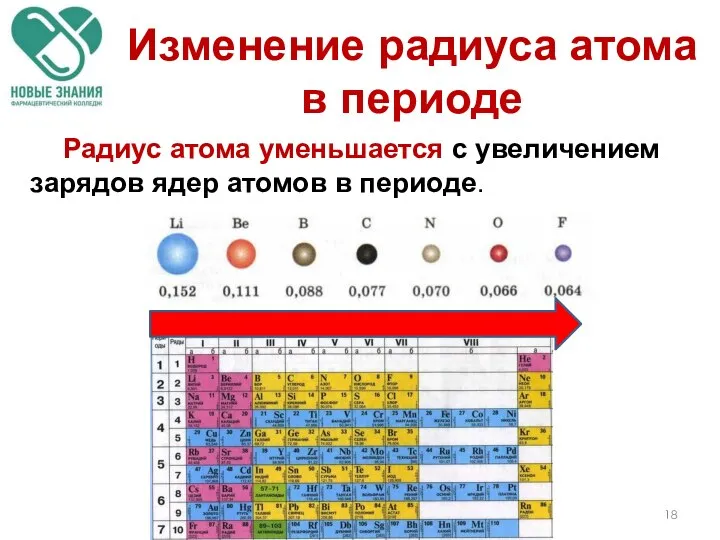
- 18. Радиус атома уменьшается с увеличением зарядов ядер атомов в периоде. Изменение радиуса атома в периоде
- 19. В одной группе с увеличением номера периода атомные радиусы возрастают. Изменение радиуса атома в периоде
- 20. Электроотрицательность - это способность атома притягивать электронную плотность. Электроотрицательность в периоде увеличивается с возрастанием заряда ядра
- 21. Электроотрицательность в группе увеличивается с уменьшением числа электронных слоев атома (снизу вверх). Самым электроотрицательным элементом является
- 22. Li 0,98 Na 0,93 К 0,91 Rb 0,89 Be 1,5 Mg 1,2 Ca 1,04 Sr 0,99
- 23. Восстановительные свойства атомов - способность терять электроны при образовании химической связи. Окислительные свойства атомов -способность принимать
- 24. В главных подгруппах снизу вверх, в периодах – слева направо окислительные свойства простых веществ элементов возрастают,
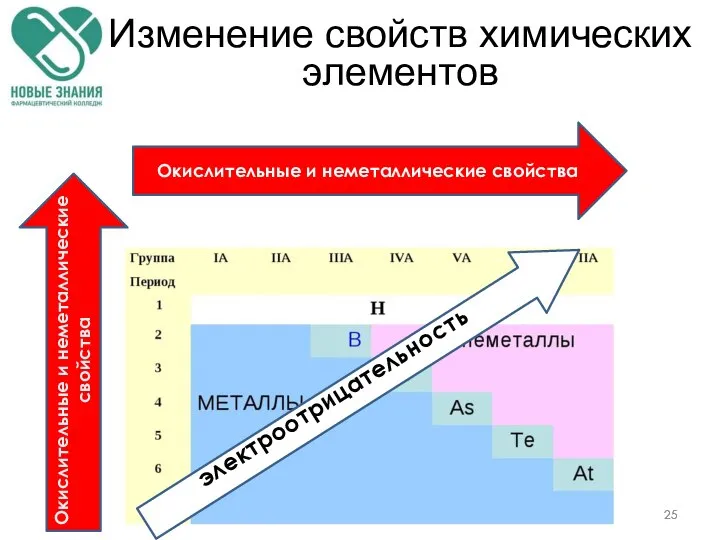
- 25. Изменение свойств химических элементов электроотрицательность Окислительные и неметаллические свойства Окислительные и неметаллические свойства
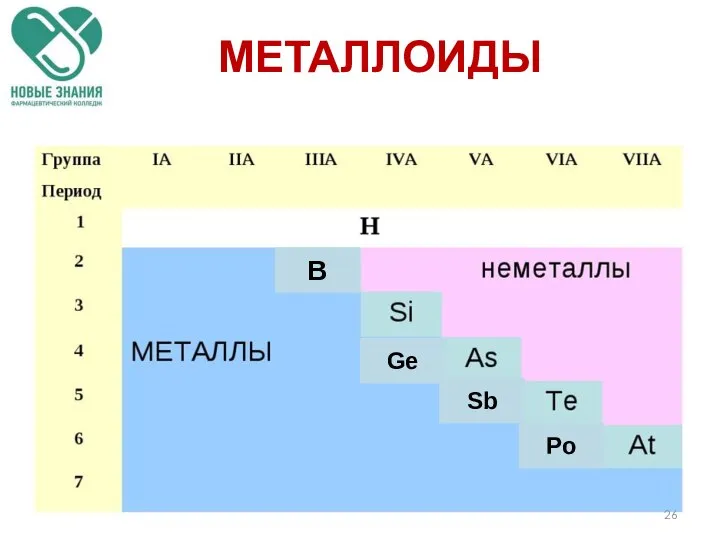
- 26. МЕТАЛЛОИДЫ Ge Sb Po B
- 27. МЕТАЛЛОИДЫ По своим химическим свойствам полуметаллы являются неметаллами, но по типу проводимости относятся к проводникам.
- 29. Скачать презентацию

















 Карбоцепные полимеры
Карбоцепные полимеры Сравнение относительной эффективности предполагаемых ингибиторов коррозии методом гальванопары
Сравнение относительной эффективности предполагаемых ингибиторов коррозии методом гальванопары Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Презентация на тему Электронное и пространственное строение молекулы метана
Презентация на тему Электронное и пространственное строение молекулы метана  Презентация на тему Войди в природу другом
Презентация на тему Войди в природу другом  Сера, значение и применение
Сера, значение и применение Применения химического анализа людьми в разных родах занятий
Применения химического анализа людьми в разных родах занятий Неметаллы азот
Неметаллы азот Химико-металлургические методы
Химико-металлургические методы Презентация на тему Химия и сельское хозяйство
Презентация на тему Химия и сельское хозяйство  Методика исследования роста оксида кремния SiO2 c помощью РФЭС. Лекция 2
Методика исследования роста оксида кремния SiO2 c помощью РФЭС. Лекция 2 Особенности базового курса органической химии издательства «ОЛМА»
Особенности базового курса органической химии издательства «ОЛМА» Предельные углеводороды. Тест 19
Предельные углеводороды. Тест 19 Разбор 25 задания. Установим соответствие
Разбор 25 задания. Установим соответствие Ионные уравнения реакций
Ионные уравнения реакций Химия элементов VIA группы
Химия элементов VIA группы Альдегиды, свойства, получение, применение
Альдегиды, свойства, получение, применение Стеклоткани. Виды стеклотканей
Стеклоткани. Виды стеклотканей Строение веществ
Строение веществ Окислительно-восстановительные свойства неорганических кислот
Окислительно-восстановительные свойства неорганических кислот Классы неорганических соединений
Классы неорганических соединений Реакции поликонденсации
Реакции поликонденсации Сталь. Химический состав стали
Сталь. Химический состав стали Презентация на тему Радиация и её воздействие на человека
Презентация на тему Радиация и её воздействие на человека  Производство метанола
Производство метанола Олимпиада Ломоносов
Олимпиада Ломоносов Строение и свойства циклоалканов
Строение и свойства циклоалканов Современная аналитическая химия.Учебная литература
Современная аналитическая химия.Учебная литература