Содержание
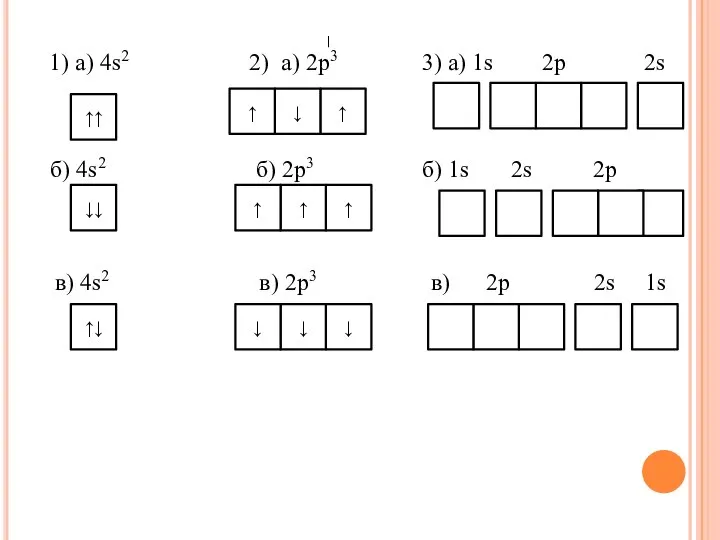
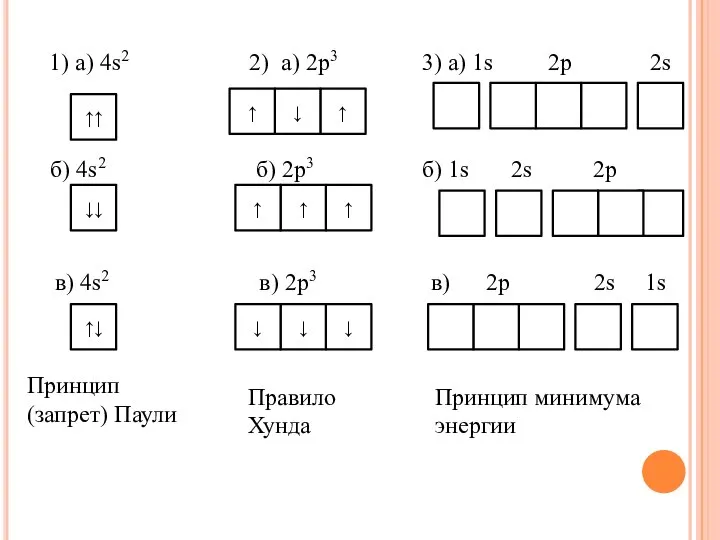
- 3. 1) а) 4s2 2) а) 2р3 3) а) 1s 2p 2s б) 4s2 б) 2р3 б)
- 4. Тема урока Правила заполнения орбиталей электронами
- 5. 1. По каким правилам идет заполнение электронами электронных орбиталей? 2. Как ими пользоваться? 3. Зачем нужны
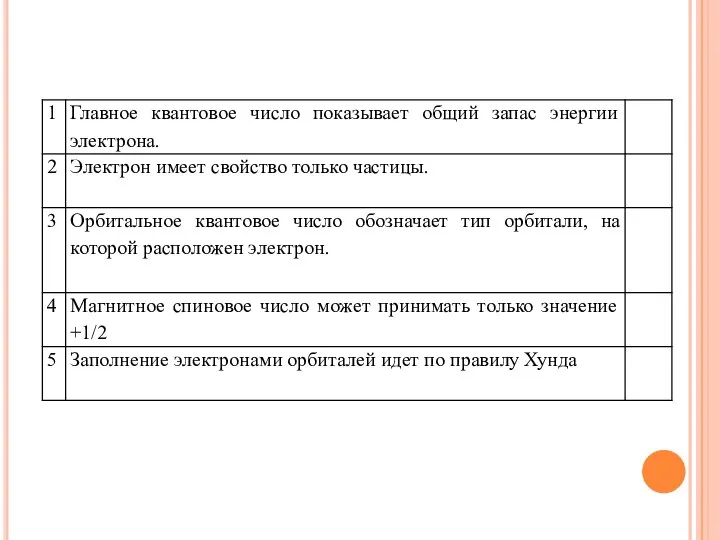
- 6. 1 задание: Найти значение квантовых чисел 2 задание: Сформулировать правила 1 задача 3 задание: Подготовить выступление
- 7. 1) а) 4s2 2) а) 2р3 3) а) 1s 2p 2s б) 4s2 б) 2р3 б)
- 8. Правила Клечковского: 1 правило: Электрон в атоме в первую очередь занимает подуровень с наименьшим значением n+l
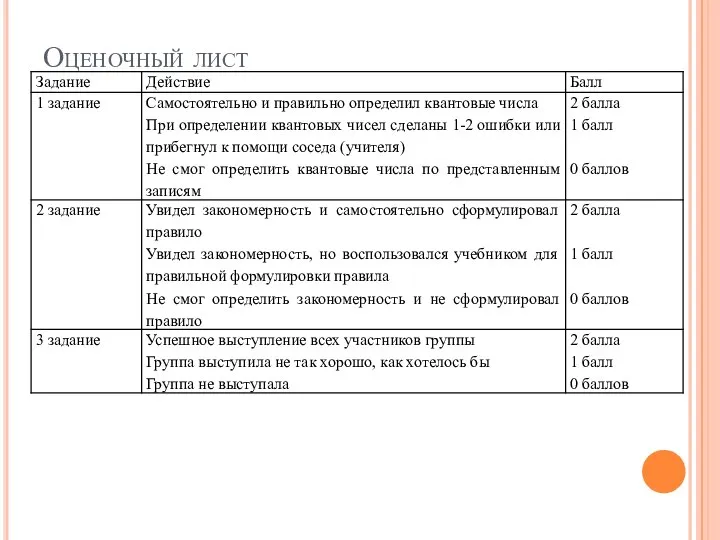
- 9. Оценочный лист
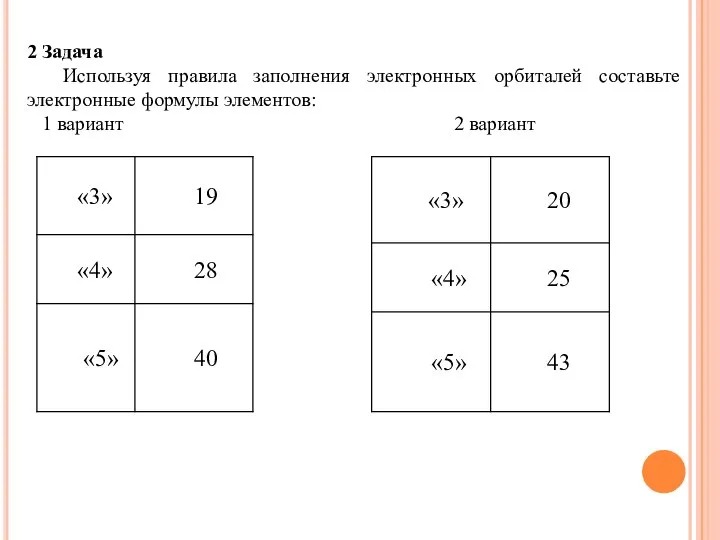
- 10. 2 Задача Используя правила заполнения электронных орбиталей составьте электронные формулы элементов: 1 вариант 2 вариант
- 11. https://www.youtube.com/watch?v=sBclKs3crno&feature=youtu.be
- 13. Скачать презентацию





 Газ тәрізді өнімдер бромды сутек
Газ тәрізді өнімдер бромды сутек Предельные углеводороды (алканы)
Предельные углеводороды (алканы) Физические величины для подсчета числа частиц вещества
Физические величины для подсчета числа частиц вещества Сопротивление материалов коррозии
Сопротивление материалов коррозии Углеводороды. Урок-игра
Углеводороды. Урок-игра Dereglarea metabolismului
Dereglarea metabolismului Алканы
Алканы Арены. Электронное строение молекулы бензола. Гомологический ряд аренов, номенклатура, изомерия
Арены. Электронное строение молекулы бензола. Гомологический ряд аренов, номенклатура, изомерия Растворы. Определение
Растворы. Определение Химические реактивы
Химические реактивы Типы химической связи
Типы химической связи Различия в молекулярном строении газов, жидкостей и твердых тел
Различия в молекулярном строении газов, жидкостей и твердых тел Химические процессы на кухне (урок №7)
Химические процессы на кухне (урок №7) Металлическая и водородная и химическая связь
Металлическая и водородная и химическая связь 1.2. Измерения веществ
1.2. Измерения веществ Сероводород и сульфиды
Сероводород и сульфиды Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Конструирование макромолекул методом ATRP
Конструирование макромолекул методом ATRP Сода: мифы и реальность
Сода: мифы и реальность Электролитическая диссоциация
Электролитическая диссоциация Cиликат кальция
Cиликат кальция Научный эксперимент в химической технологии
Научный эксперимент в химической технологии Закон эквивалентов
Закон эквивалентов Презентация на тему Алюминий(Al)
Презентация на тему Алюминий(Al)  Ступенчатые процессы получения полимеров: полиприсоединение, поликонденсация
Ступенчатые процессы получения полимеров: полиприсоединение, поликонденсация Получение аминов
Получение аминов Химические свойства воды
Химические свойства воды Основания. Состав оснований
Основания. Состав оснований