Содержание
- 2. Основания - сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (-ОН). Хорошо
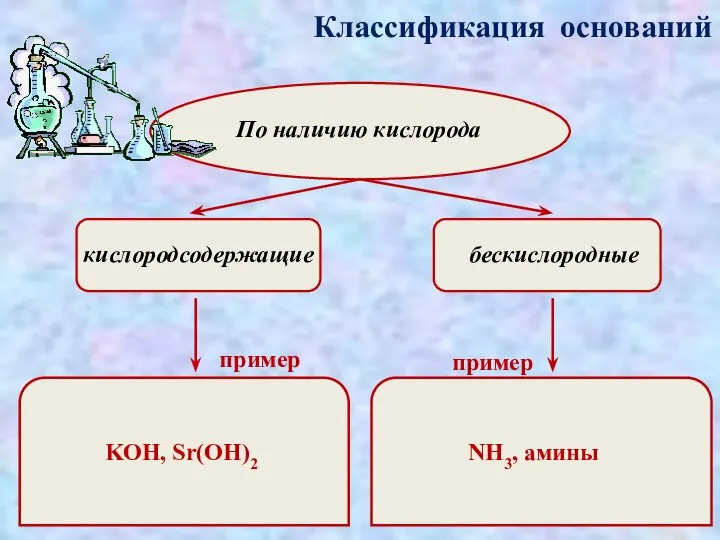
- 3. Классификация оснований По наличию кислорода кислородсодержащие бескислородные пример пример KOH, Sr(OH)2 NH3, амины
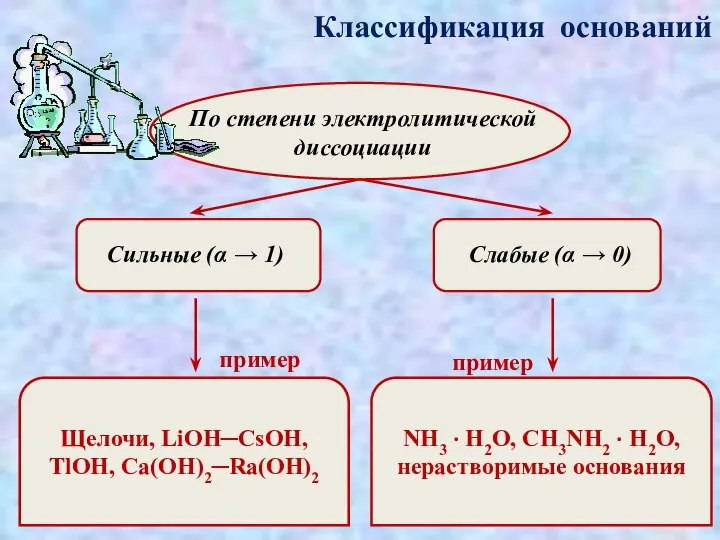
- 4. Классификация оснований По степени электролитической диссоциации Сильные (α → 1) Слабые (α → 0) пример пример
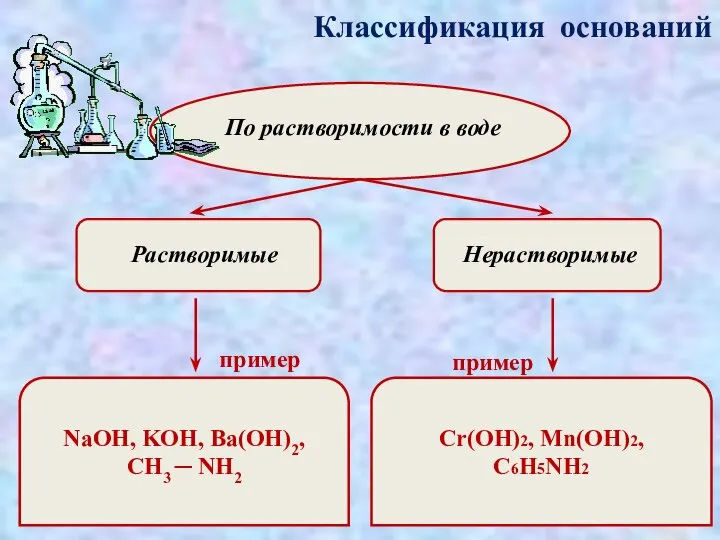
- 5. Классификация оснований По растворимости в воде Растворимые Нерастворимые пример пример NaOH, KOH, Ba(OH)2, CH3 ─ NH2
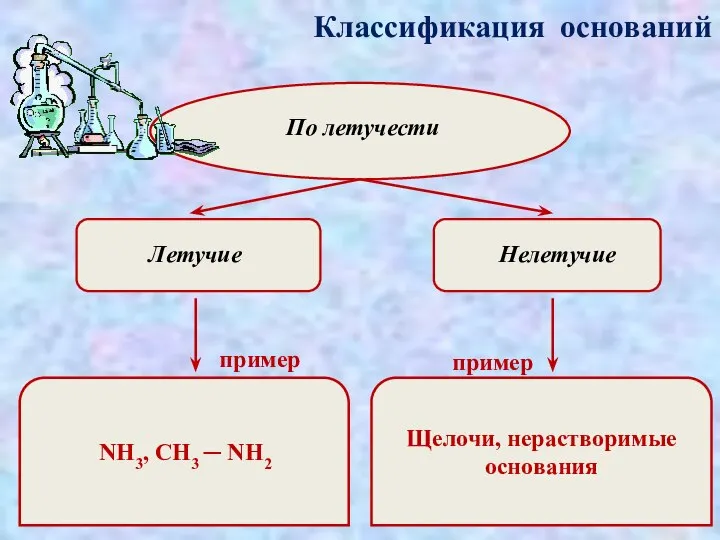
- 6. Классификация оснований По летучести Летучие Нелетучие пример пример NH3, CH3 ─ NH2 Щелочи, нерастворимые основания
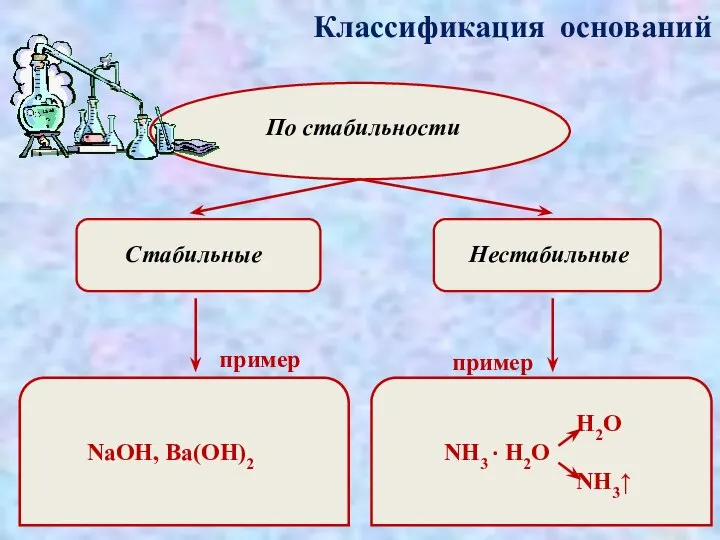
- 7. Классификация оснований По стабильности Стабильные Нестабильные пример пример NaOH, Ba(OH)2 H2O NH3 · H2O NH3↑
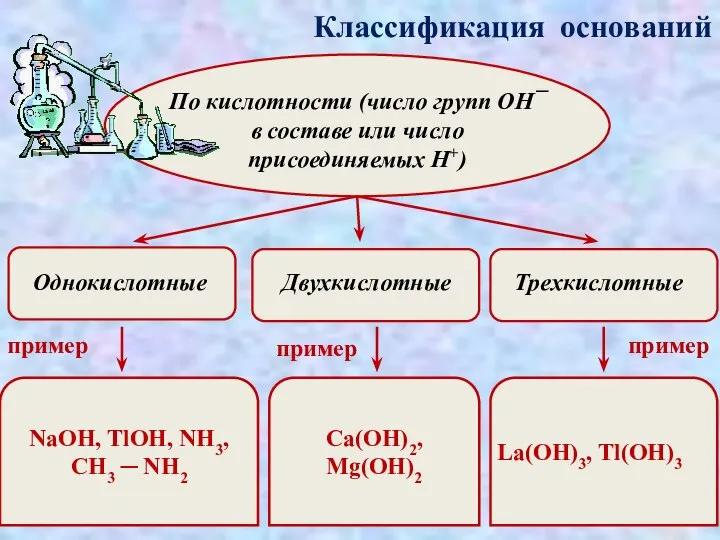
- 8. Классификация оснований По кислотности (число групп ОН¯ в составе или число присоединяемых H+) пример пример NaOH,
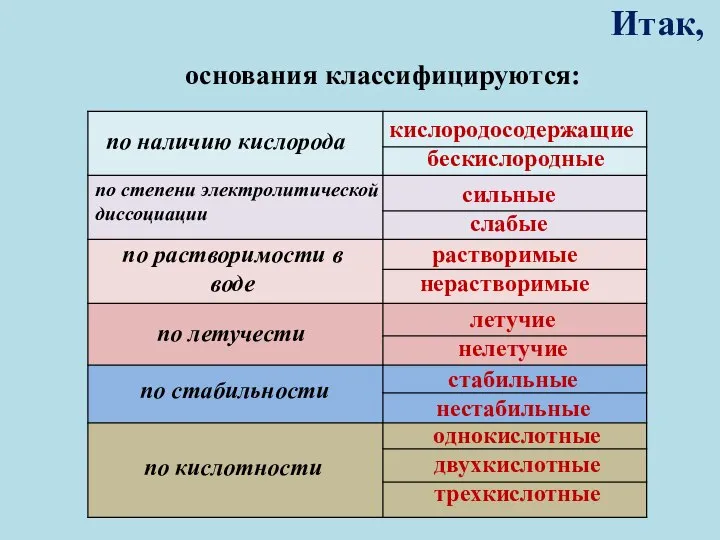
- 9. Итак, основания классифицируются: по наличию кислорода по степени электролитической диссоциации по растворимости в воде по летучести
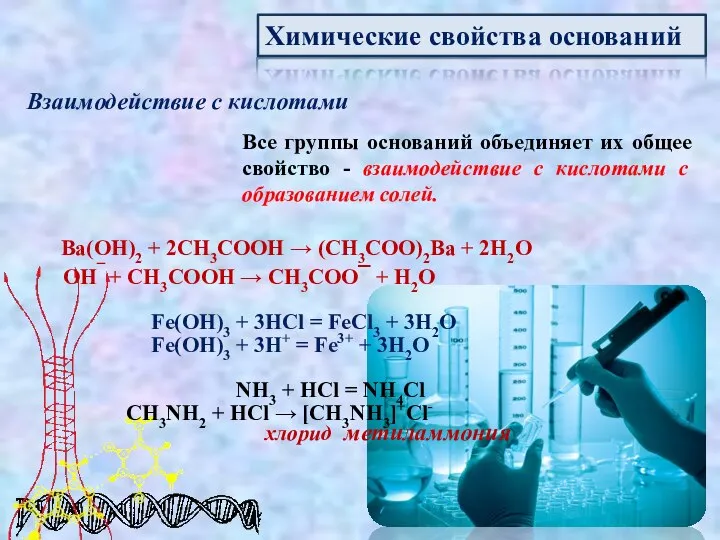
- 10. Химические свойства оснований Взаимодействие с кислотами Все группы оснований объединяет их общее свойство - взаимодействие с
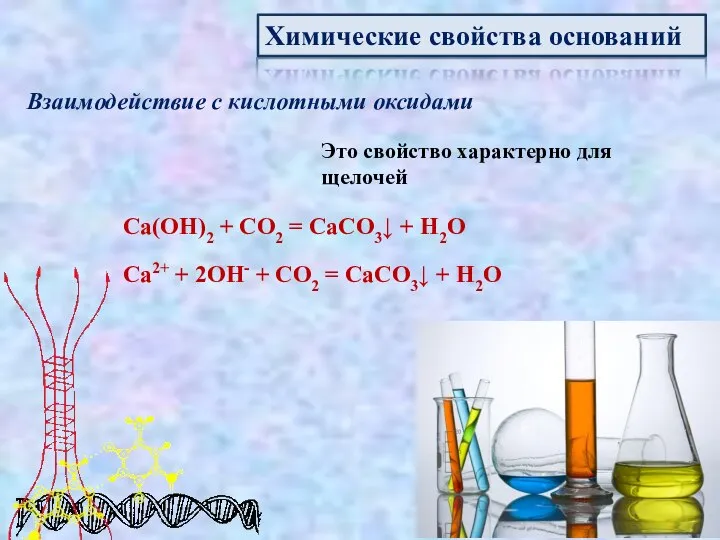
- 11. Химические свойства оснований Взаимодействие с кислотными оксидами Это свойство характерно для щелочей Ca(OH)2 + CO2 =
- 12. Химические свойства оснований Взаимодействие с солями Эти химические реакции подчиняются общему правилу условий протекания реакций между
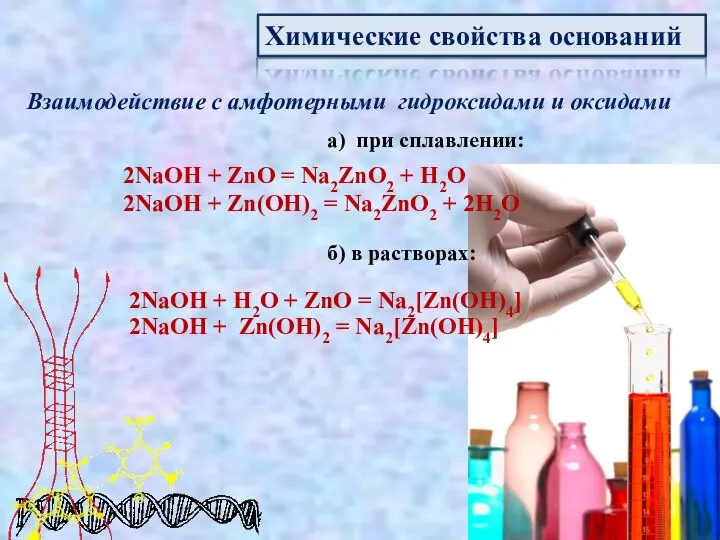
- 13. Химические свойства оснований Взаимодействие с амфотерными гидроксидами и оксидами а) при сплавлении: 2NaOH + ZnO =
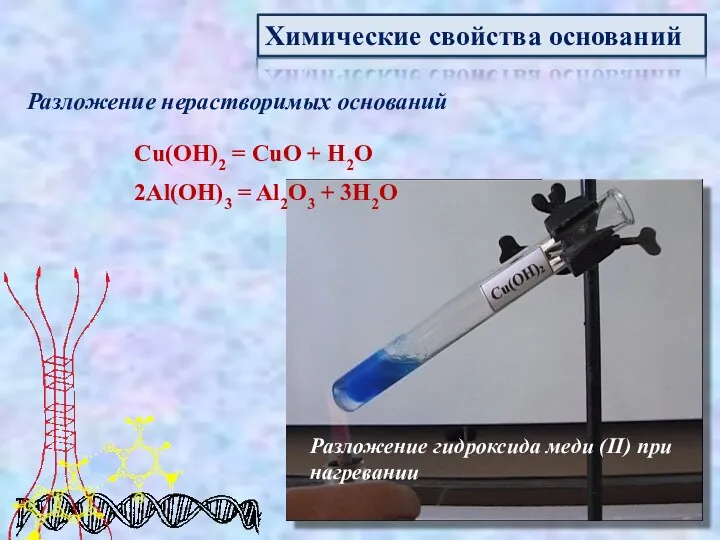
- 14. Химические свойства оснований Разложение нерастворимых оснований Cu(OH)2 = CuO + H2O 2Al(OH)3 = Al2O3 + 3H2O
- 15. Закрепляем тему Вопрос № 1 К реакции нейтрализации можно отнести взаимодействие
- 16. Закрепляем тему Вопрос № 2 При нагревании будет разлагаться на оксид и воду
- 17. Закрепляем тему Вопрос № 3 При обычных условиях основания
- 18. Закрепляем тему Вопрос № 4 Соль и вода образуются при взаимодействии
- 19. Закрепляем тему Вопрос № 5 Будет вступать в реакцию с соляной кислотой
- 20. Закрепляем тему Вопрос № 6 При приливании раствора гидроксида натрия к раствору сульфата меди (II)
- 21. Закрепляем тему Вопрос № 7 В растворах щелочей лакмус и метилоранж соответственно изменяют свои цвета на
- 22. Закрепляем тему Вопрос № 8 В уравнении реакции натрия с водой коэффициент перед водородом равен
- 23. Закрепляем тему Вопрос № 9 В реакцию с гидроксидом бария вступает
- 25. Скачать презентацию











 Периодический закон Д. Менделеева с точки зрения строения атома. Часть 1
Периодический закон Д. Менделеева с точки зрения строения атома. Часть 1 Искусство фотографии и химия
Искусство фотографии и химия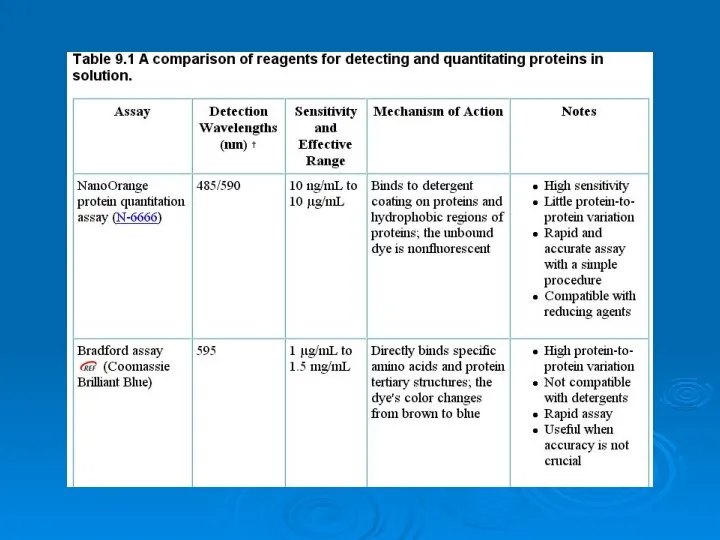 Analysis of proteins
Analysis of proteins Задачи химической кинетики
Задачи химической кинетики Железо и его соединения
Железо и его соединения Алканы. Химические свойства. Применение
Алканы. Химические свойства. Применение Направление процесса. ОВР
Направление процесса. ОВР Синтез 7,7 - дихлоробицикло [4.1.0] гептана
Синтез 7,7 - дихлоробицикло [4.1.0] гептана Кремний и 4 группа. 9 класс
Кремний и 4 группа. 9 класс Металлы. Общая характеристика ( 9 класс)
Металлы. Общая характеристика ( 9 класс) Пропитка рубинов и сапфиров
Пропитка рубинов и сапфиров Амины, азо- и диазосоединения (продолжение)
Амины, азо- и диазосоединения (продолжение) Газовые смеси. Способы задания газовых смесей. Лекция 5
Газовые смеси. Способы задания газовых смесей. Лекция 5 Структура периодической таблицы
Структура периодической таблицы Обобщение знаний по теме атомы химических элементов. Химическая связь
Обобщение знаний по теме атомы химических элементов. Химическая связь Презентация на тему Аминокислоты и белки: строение и свойства
Презентация на тему Аминокислоты и белки: строение и свойства  Железо в продуктах питания
Железо в продуктах питания Производство аммиака
Производство аммиака Металлы и неметаллы. Ознакомление с общими физическими свойствами металлов и неметаллов
Металлы и неметаллы. Ознакомление с общими физическими свойствами металлов и неметаллов kristallichekaya_reshenka_vidy
kristallichekaya_reshenka_vidy Кальций, железо. Горение стальной ваты и железного порошка
Кальций, железо. Горение стальной ваты и железного порошка Сравнение активностей металлов
Сравнение активностей металлов Презентация по Химии "Химическая номенклатура и филология"
Презентация по Химии "Химическая номенклатура и филология"  Презентация на тему Строение и свойства циклоалканов
Презентация на тему Строение и свойства циклоалканов  Кислоты с металлами
Кислоты с металлами Многообразие веществ
Многообразие веществ Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Химическая кинетика. Основные понятия. Основы формальной кинетики
Химическая кинетика. Основные понятия. Основы формальной кинетики