Содержание
- 2. После открытия строения атома Периодический закон имеет следующий вид: Свойства элементов, простых веществ и их соединений
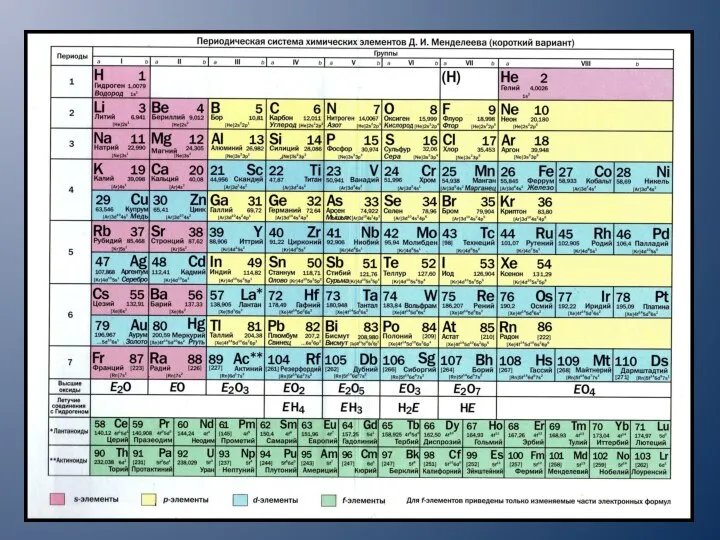
- 4. СТРУКТУРА ТАБЛИЦЫ ЭЛЕМЕНТОВ Д.И.МЕНДЕЛЕЕВА В таблице все элементы расположены в порядке возрастания их порядкового номера. Порядковый
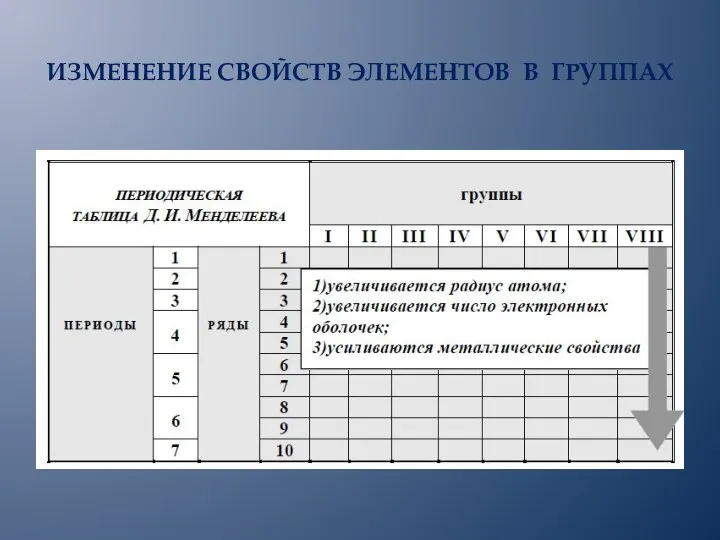
- 5. Номер периода соответствует числу энергетических уровней в атоме, которые заполняются электронами. ГРУППЫ В таблице Менделеева по
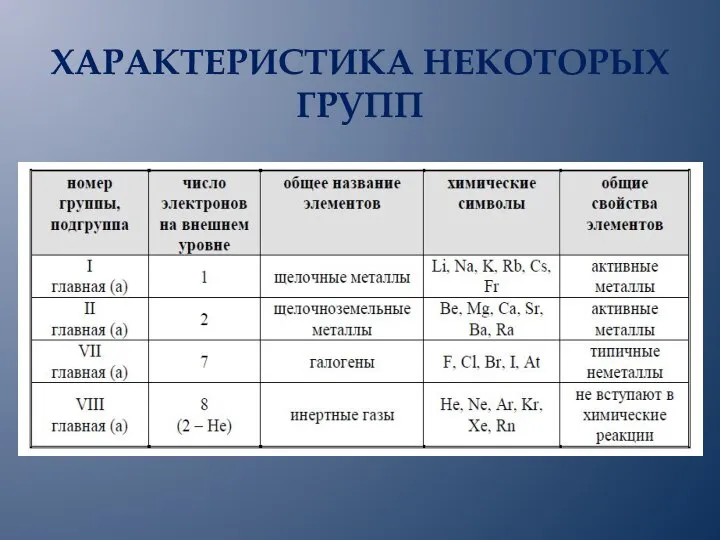
- 7. ХАРАКТЕРИСТИКА НЕКОТОРЫХ ГРУПП
- 8. На внешнем энергетическом уровне атомов не может находиться более восьми электронов. Номер группы соответствует числу электронов
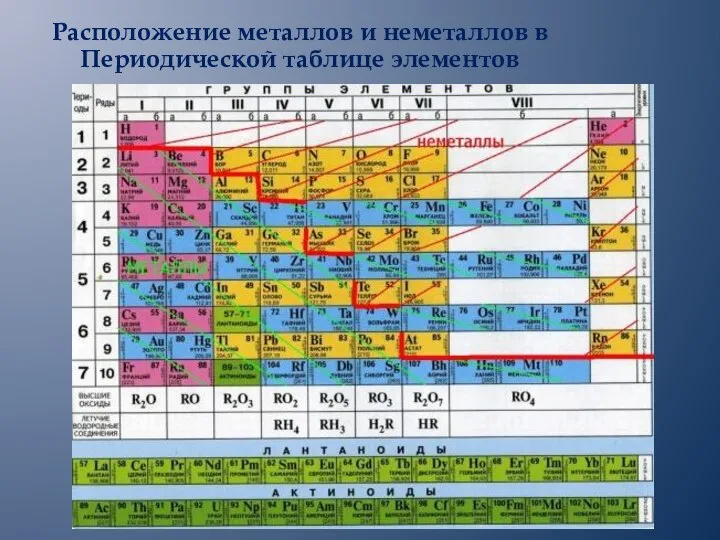
- 9. Расположение металлов и неметаллов в Периодической таблице элементов
- 10. Схематическое изображение расположения металлов и неметаллов в Периодической таблице элементов Все d- и f- элементы –
- 11. ТИПЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Металлы – это элементы, которые обладают высокими металлическими свойствами, т.е. их атомы способны
- 12. Неметаллы Неметаллические свойства – это способность атома принимать электроны от других атомов (высокая электроотрицательность).
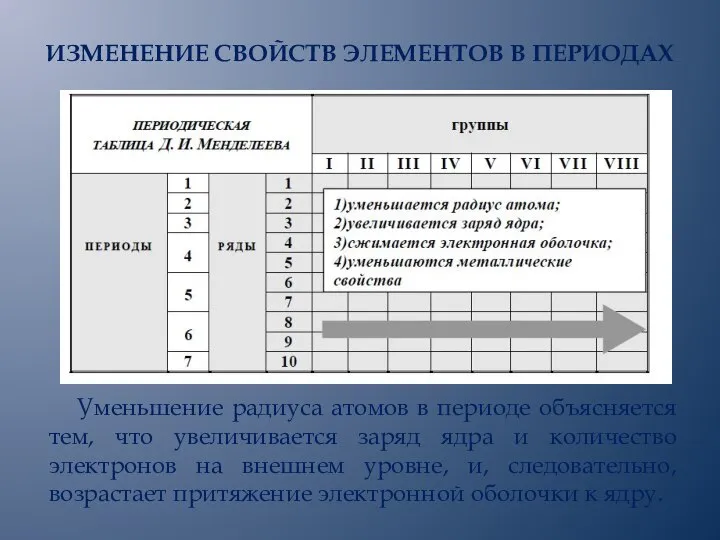
- 13. ИЗМЕНЕНИЕ СВОЙСТВ ЭЛЕМЕНТОВ В ПЕРИОДАХ Уменьшение радиуса атомов в периоде объясняется тем, что увеличивается заряд ядра
- 14. ИЗМЕНЕНИЕ СВОЙСТВ ЭЛЕМЕНТОВ В ГРУППАХ
- 16. Скачать презентацию








 Физическая химия, термодинамика
Физическая химия, термодинамика Биопластик на основе лигнина
Биопластик на основе лигнина Проверочные работы по темам: Неметаллы. 9 класс
Проверочные работы по темам: Неметаллы. 9 класс Классы неорганических соединений (основания)
Классы неорганических соединений (основания) Презентация на тему Основания 8 класс
Презентация на тему Основания 8 класс  Порох. Сера, халькогены
Порох. Сера, халькогены Золото. Физические свойства золота
Золото. Физические свойства золота Алкины
Алкины Положение металлов в периодической системе Д.И. Менделеева и особенности строения их атомов
Положение металлов в периодической системе Д.И. Менделеева и особенности строения их атомов Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Общие знания по курсу неорганической химии
Общие знания по курсу неорганической химии 5 группа элементов
5 группа элементов СТЕПЕНЬ ОКИСЛЕНИЯ
СТЕПЕНЬ ОКИСЛЕНИЯ Презентация по Химии "Получение уксусной кислоты и опыты с ней"
Презентация по Химии "Получение уксусной кислоты и опыты с ней"  Адреномиметические средства
Адреномиметические средства Кристаллическое строение металлов и сплавов. Аморфные и кристаллические тела
Кристаллическое строение металлов и сплавов. Аморфные и кристаллические тела Бөлу процестерінің тиімділігін бағалау әдістерін таңдау және таңдау принциптері
Бөлу процестерінің тиімділігін бағалау әдістерін таңдау және таңдау принциптері Структура периодической таблицы элементов
Структура периодической таблицы элементов Карбоновые кислоты (химические свойства)
Карбоновые кислоты (химические свойства) Растворы электролитов
Растворы электролитов Коррозия металлов. Способы защиты от коррозии
Коррозия металлов. Способы защиты от коррозии Учебная дисциплина Естествознание. Раздел II. Химия
Учебная дисциплина Естествознание. Раздел II. Химия Алкадиены. Строение. Изомерия. Свойства
Алкадиены. Строение. Изомерия. Свойства Эмульсии как лиофобные дисперсные системы
Эмульсии как лиофобные дисперсные системы Строение атома алюминия. Физические и химические свойства алюминия
Строение атома алюминия. Физические и химические свойства алюминия 1
1 Реакции соединения и разложения
Реакции соединения и разложения Химические украшения из металла. Защита проекта
Химические украшения из металла. Защита проекта