Содержание
- 2. ПЛАН: 1. КАЛЬЦИЙ – КАК ХИМИЧЕСКИЙ ЭЛЕМЕНТ 2. НЕМНОГО ОБ ИСТОРИИ… 3. РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. 4.
- 3. В латинском языке слово «calx» обозначает известь и сравнительно мягкие, легко обрабатываемые камни, в первую очередь
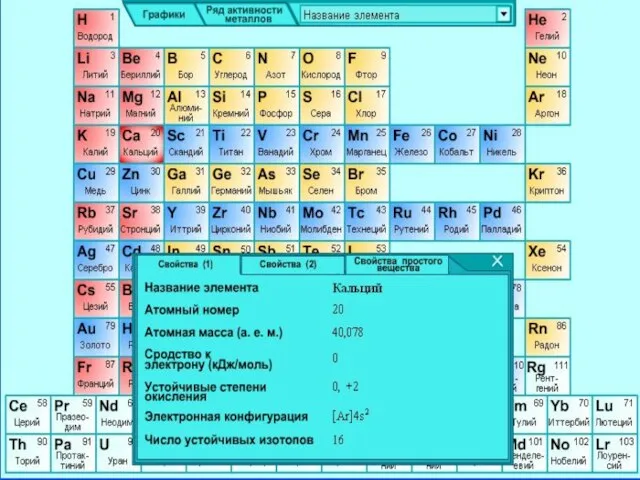
- 4. Природный элемент представляет смесь шести стабильных изотопов: 40Ca, 42Ca, 43Ca, 44Ca, 46Ca 48Ca, из которых наиболее
- 6. Вильгельм Бунзен Немецкий химик. Разработал ряд методов исследования химических веществ. Получил посредством электролиза кальций, марганец, магний
- 7. В биосфере происходит исключительно резкая дифференциация Ca, связанная главным образом с "карбонатным равновесием": при взаимодействии углекислого
- 8. Эта реакция обратима и является основой перераспределения Ca. При высоком содержании CO2 в водах Ca находится
- 9. КАЛЬЦИЙ СОДЕРЖИТСЯ В ГОРНЫХ ПОРОДАХ .
- 10. В солончаках и соленых озерах часто накапливается гипс Ca SO4*2H2O
- 11. Реки приносят в океан много кальция (0,04%), который концентрируется в скелетах организмов.
- 12. Он присутствует во всех тканях и жидкостях живых организмов.
- 13. Залежи кальция - в соляных наплывах
- 14. СТАЛАГМИТ
- 15. Содержание кальция в организме человека достигает 2 %.
- 16. СТАЛАГМИТ
- 17. Бетон – важнейший строительный материал наших дней, одной из составных частей которого является кальций.
- 18. ФИЗИЧЕСКИЕ СВОЙСТВА 1.Имеет металлическую кристаллическую решётку. 2.Атомный радиус - 1,97. 3.Ионный радиус Са2+- 1,04. 4.Плотность –
- 19. Химические свойства Кальций в результате реакции отдает 2 электрона, т.е. окисляется: Ca2+ – 2е → Caо
- 20. Химически Ca очень активен. При обычной температуре Ca легко взаимодействует с кислородом и влагой воздуха, поэтому
- 21. Кальций взаимодействие с простыми веществами – неметаллами. Ca + 2 C = CaC2 карбид кальция 2.
- 22. - С фтором реагирует на холоду: Са+|F2 = CaF2 -C хлором и бромом при температуре свыше
- 23. Трудно вступают в реакцию с азотом и фосфором: ЗСа + N2 = Са3N2 (нитрид магния) ЗСа
- 24. Получение и применение. В промышленности кальций получают двумя способами: 1.Нагреванием брикетированной смеси СаО и порошка Al
- 26. Скачать презентацию





















 Экономическое значение инвазионных болезней в агропромышленном комплексе. Химиопрофилактика инвазионных болезней
Экономическое значение инвазионных болезней в агропромышленном комплексе. Химиопрофилактика инвазионных болезней Металлы и их соединения
Металлы и их соединения Кроссворд Интересные факты в химии
Кроссворд Интересные факты в химии Изучение основных породообразующих минералов горных пород. Лабораторная работа №1
Изучение основных породообразующих минералов горных пород. Лабораторная работа №1 Химическая реакция
Химическая реакция Химическая реакция в потоке в одномерном случае. Уравнение неразрывности
Химическая реакция в потоке в одномерном случае. Уравнение неразрывности Алкены. Гомологический ряд алкенов. Изомерия алкенов. Химические свойства алкенов
Алкены. Гомологический ряд алкенов. Изомерия алкенов. Химические свойства алкенов Алкены (этиленовые углеводороды)
Алкены (этиленовые углеводороды) Экстракция и кристаллизация
Экстракция и кристаллизация Электронные оболочки атомов
Электронные оболочки атомов Соединения щелочноземельных металлов
Соединения щелочноземельных металлов Простые и сложные вещества
Простые и сложные вещества Классификация органических веществ Химия. 10 класс Абрамова С.И.
Классификация органических веществ Химия. 10 класс Абрамова С.И. Непредельные карбоновые кислоты
Непредельные карбоновые кислоты Презентация на тему Кремний и его соединения
Презентация на тему Кремний и его соединения  Жиры. Классификация
Жиры. Классификация Активизация познавательной деятельности на уроках химии при работе с МГП (малыми графическими пособиями)
Активизация познавательной деятельности на уроках химии при работе с МГП (малыми графическими пособиями) Порядок в жидкостях
Порядок в жидкостях Окисление парафинов
Окисление парафинов Формирование полимерной структуры при отверждении олигомеров. Каучуки и резины
Формирование полимерной структуры при отверждении олигомеров. Каучуки и резины Ароматические и гетероциклические соединения. Электронная спектроскопия
Ароматические и гетероциклические соединения. Электронная спектроскопия Электролиты и неэлектролиты. Электролитическая диссоциация
Электролиты и неэлектролиты. Электролитическая диссоциация Интерактивная интеллектуальная игра Юный химик
Интерактивная интеллектуальная игра Юный химик Презентация на тему Важнейшие соединения серы
Презентация на тему Важнейшие соединения серы 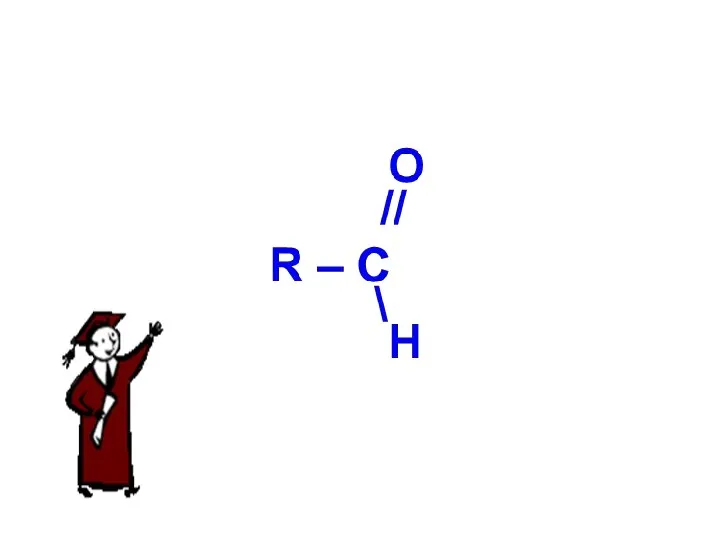 Карбоновые кислоты
Карбоновые кислоты Химические элементы
Химические элементы Предельные углеводороды. Лекция 2
Предельные углеводороды. Лекция 2 Пайданалылған майларды қолдана отырып көмірді брикеттер алу
Пайданалылған майларды қолдана отырып көмірді брикеттер алу