Содержание
- 2. 1896 г. Анри Беккерель (франц.) открыл явление радиоактивности. Радиоактивность – способность атомов к самопроизвольному излучению. 1899
- 3. Опыты Резерфорда 1. В толстостенный свинцовый сосуд положили крупицу радия. Излучение радия обнаружили с помощью фотопластинки.
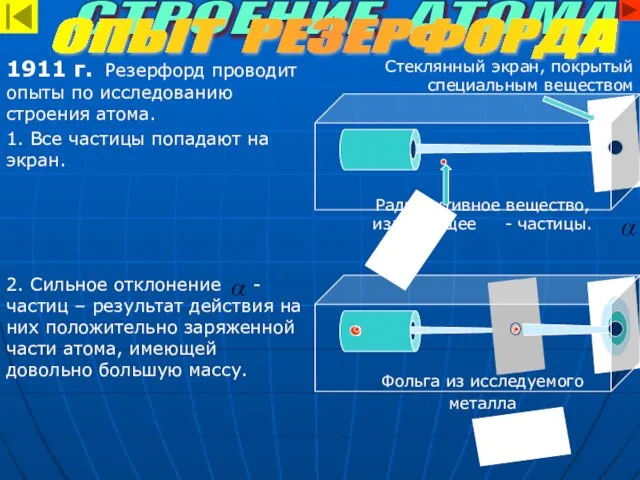
- 4. Стеклянный экран, покрытый специальным веществом Радиоактивное вещество, излучающее - частицы. Фольга из исследуемого металла 1911 г.
- 5. - частицы ядро По Резерфорду атом имеет планетарное строение. В центре находится положительно заряженное ядро. Вокруг
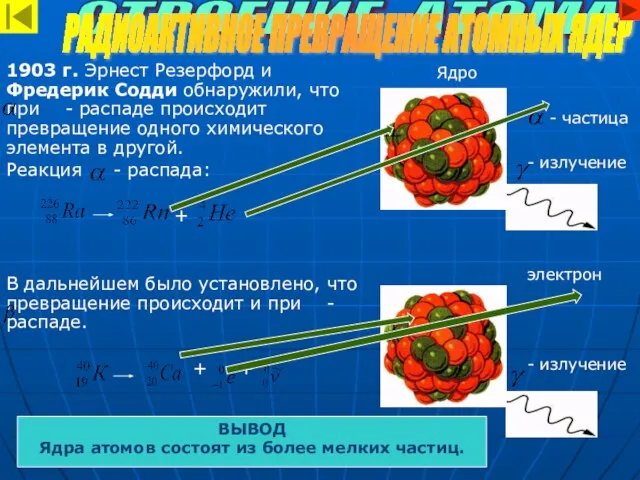
- 6. 1903 г. Эрнест Резерфорд и Фредерик Содди обнаружили, что при - распаде происходит превращение одного химического
- 7. 1919 г. Резерфорд исследовал взаимодействие - частиц с ядрами атомов азота. При этом, из ядра атома
- 8. 1920 г. Резерфорд предполагает существование в ядре нейтральной частицы с массой равной массе протона. В 30-х
- 9. N – число нейтронов 1932 г. Д.Д.Иваненко (рус.), В.Гейзенберг (нем.) предложили протонно-нейтронную модель строения ядра: ядро
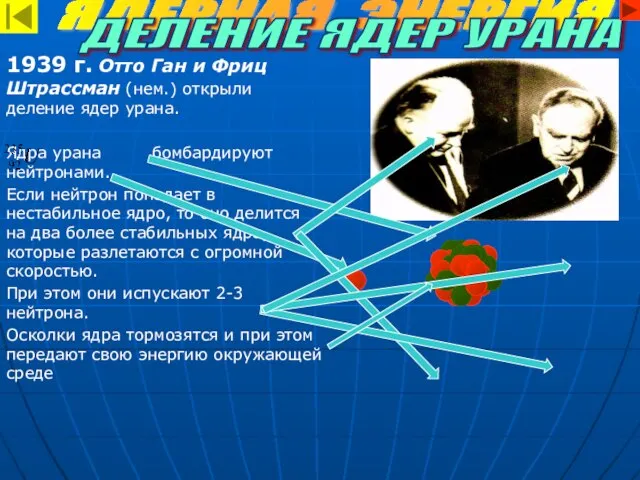
- 10. ЯДЕРНАЯ ЭНЕРГИЯ 1939 г. Отто Ган и Фриц Штрассман (нем.) открыли деление ядер урана. Ядра урана
- 11. ЯДЕРНАЯ ЭНЕРГИЯ ЦЕПНАЯ РЕАКЦИЯ
- 12. ФАКТОРЫ, ВЛИЯЮЩИЕ НА ПРОТЕКАНИЕ ЦЕПНОЙ РЕАКЦИИ 1. МАССА УРАНА. 2. НАЛИЧИЕ ОТРАЖАЮЩЕЙ ОБОЛОЧКИ (бериллий). 3. НАЛИЧИЕ
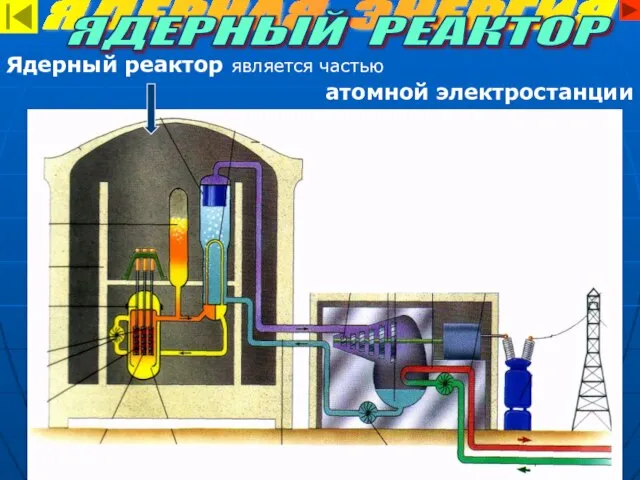
- 13. Ядерный реактор является частью атомной электростанции ЯДЕРНАЯ ЭНЕРГИЯ ЯДЕРНЫЙ РЕАКТОР
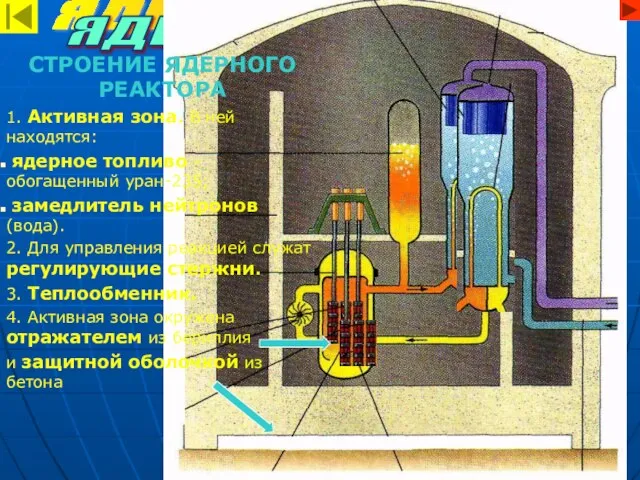
- 14. ЯДЕРНАЯ ЭНЕРГИЯ ЯДЕРНЫЙ РЕАКТОР СТРОЕНИЕ ЯДЕРНОГО РЕАКТОРА 1. Активная зона. В ней находятся: ядерное топливо –
- 15. ПРИНЦИП ДЕЙСТВИЯ ЯДЕРНОГО РЕАКТОРА 1. В активной зоне происходит управляемая ядерная реакция, в результате которой выделяется
- 16. 1. АТОМНЫЕ ЭЛЕКТРОСТАНЦИИ. 1942 г. Под руководством Э.Ферми в США был построен первый ядерный реактор. 1946
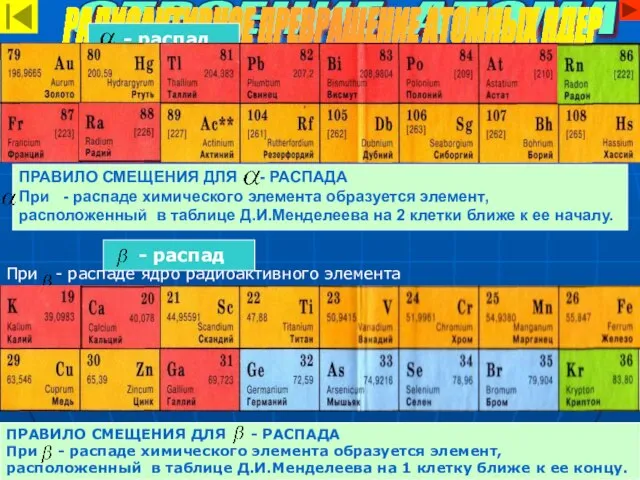
- 17. ПРАВИЛО СМЕЩЕНИЯ ДЛЯ - РАСПАДА При - распаде химического элемента образуется элемент, расположенный в таблице Д.И.Менделеева
- 18. Массовые числа химических элементов. Зарядовые числа химических элементов. СТРОЕНИЕ АТОМА РАДИОАКТИВНОЕ ПРЕВРАЩЕНИЕ АТОМНЫХ ЯДЕР 222 226
- 19. ИЗОТОПЫ –разновидности химического элемента, различающиеся по массе атомных ядер. СТРОЕНИЕ АТОМА ИЗОТОПЫ 234 92 U 235
- 21. Скачать презентацию












 Алканы 10-класс
Алканы 10-класс Кислород и сера
Кислород и сера Клеящие материалы
Клеящие материалы Типы реакций в неорганической химии. Гидролиз. Электролиз
Типы реакций в неорганической химии. Гидролиз. Электролиз Получение аминов
Получение аминов Тест по неметаллам
Тест по неметаллам Тест по теме: Алкины
Тест по теме: Алкины Авиационное материаловедение. Лекция №1: Введение. Теория сплавов
Авиационное материаловедение. Лекция №1: Введение. Теория сплавов Амины. Аминокислоты
Амины. Аминокислоты Карбоновые кислоты
Карбоновые кислоты Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений физические и химические явления
физические и химические явления Неорганическая химия, часть 1
Неорганическая химия, часть 1 Консультация по химии
Консультация по химии Внеклассное мероприятие по химии для учащихся 8 классов
Внеклассное мероприятие по химии для учащихся 8 классов Классификация веществ. Урок №7
Классификация веществ. Урок №7 Периодический закон и периодическая система элементов Д.И. Менделеева
Периодический закон и периодическая система элементов Д.И. Менделеева Получение и химические свойства оксидов
Получение и химические свойства оксидов Презентация на тему Факторы, влияющие на скорость химической реакции
Презентация на тему Факторы, влияющие на скорость химической реакции  Классификации по атомному весу
Классификации по атомному весу Защитить кабель. Задача 9
Защитить кабель. Задача 9 Направление химических реакций
Направление химических реакций Алкены-1 (строение, изомерия, номенклатура)
Алкены-1 (строение, изомерия, номенклатура) Ключевые реакции и регуляторные ферменты начальных этапов углеводного обмена
Ключевые реакции и регуляторные ферменты начальных этапов углеводного обмена Непредельные углеводороды
Непредельные углеводороды Вода и её свойства
Вода и её свойства Изомерия. Классификация органических веществ
Изомерия. Классификация органических веществ Понятие о веществе. Свойства веществ
Понятие о веществе. Свойства веществ