Слайд 2
Энтальпия — это свойство вещества, указывающее количество энергии, которую можно

преобразовать в теплоту. (H)
Энтропия – мера внутренней неупорядоченности системы (S)
Энергия Гиббса (G)
Реакция может протекать при благоприятном соотношении энергетического и энтропийного факторов.
ΔG 0 = ΔH 0 – T ΔS 0
Слайд 3N2 + 3H2 = 2NH3+Q ΔG 0 =-33,28 кДж , ΔS 0=

-198, 26 кДж
ΔН 0 = -92,38 кДж
6H2O + 6CO2 = C6H12O6 + 6O2 – Q ΔG 0 =-2870 кДж
C + H2O = CO2 + H2 – Q ΔG 0 = 93 кДж , ΔН 0= 132 кДж
Pb(NO3)2 + 2KI = PbI2 + KNO3 ΔG 0 = О кДж
2H2 + O2 = 2H2O + Q ΔG 0 = -474,38 кДж , ΔS 0= О, ΔН 0 =О
Слайд 4 Верите ли Вы?
Любая химическая реакция имеет право на реальное существование
Если ΔН

< 0 и ΔS < 0, то реакция самопроизвольно протекать никогда не будет
Энтропия кислорода О2 меньше чем энтропия озона О3
Самое устойчивое состояние системы – это состояние химического равновесия
Реакция фотосинтеза термодинамически запрещена
Существуют реакции, которые при нормальных условиях практически не идут, не смотря на то, что ΔG << 0
Слайд 5
Чтение с остановками
1. Предскажите, будет ли протекать данная реакция при обычных условиях.
2Н2

(г) + О2 (г) = 2Н2О (ж)
Известно, что ΔG = - 474,38 кДж ΔG << 0
Ваш ответ: реакция ___ должна протекать самопроизвольно при нормальных условиях.
_________________________________________________
2.Известно, однако, что она в этих условиях практически
не идет.
Но стоит внести в смесь………………(что?)
_________________________________________________
Слайд 63. Подходящий катализатор (мелкодисперсную платину) или просто поднести горящую спичку, реакция произойдет

со взрывом: это гремучий газ.
Получается, что термодинамика «не знает», пойдет ли реакция в действительности, а говорит только, что она термодинамически разрешена, т.е. в принципе возможна. Значит ли это, что термодинамические расчеты бесполезны?
_________________________________________________________
4. Конечно нет. Если термодинамика утверждает, что какая-либо реакция термодинамически разрешена, то можно попытаться подобрать условия (подходящий катализатор или температуру)
и осуществить ее. Это было сделано для многих важных технологических процессов. А в том случае, когда реакция термодинамически запрещена, нет смысла даже искать катализатор.
Слайд 7
5. Просто у реакции маленькая скорость. Одной реакции требуются для завершения микросекунды,

другой – миллионы лет. Почему так? Термодинамика ответить бессильна: в этой теории не учитывается время.
______________________________________________________________
Слайд 8Составить слово
М Е О Г О Т
Я И П А

Слайд 9Первый и основной принцип гомеопатии был сформулирован Ганеманом: подобное лечится подобным. Он

заключается в применении минимальных доз веществ, которые в больших дозах вызывают явления, сходные с признаками болезни. Болезни успешно излечиваются теми лекарствами, которые в состоянии вызвать в здоровом организме сходную болезнь.
Второй принцип тоже открыл Ганеман, обнаружив обострение заболеваний по ходу лечения, но избежав обострений, уменьшив дозу лекарств. Это принцип малых доз. Причем эти дозы сверхмалые. Иногда, в полученном лекарстве вообще не остаётся молекул исходного вещества, только «память» молекул воды.








 Кремневые породы
Кремневые породы Алкены (олефины)
Алкены (олефины) Алканы – строение, химические свойства
Алканы – строение, химические свойства Массовая доля химич элемента
Массовая доля химич элемента Алканы
Алканы Свойства отдельных классов неорганических и органических веществ на примере лекарственных средств
Свойства отдельных классов неорганических и органических веществ на примере лекарственных средств Классификация реагентов и реакции в органической химии
Классификация реагентов и реакции в органической химии Этапы аналитических работ
Этапы аналитических работ Презентация на тему Кремний и его соединения
Презентация на тему Кремний и его соединения  Сравнительная характеристика NO и NO2 (строение молекул, особенности поведения, устойчивость, ОК свойства)
Сравнительная характеристика NO и NO2 (строение молекул, особенности поведения, устойчивость, ОК свойства) Никель и его соединения
Никель и его соединения Каучук
Каучук Химические средства защиты растений
Химические средства защиты растений Техносферная безопасность. Химия как наука
Техносферная безопасность. Химия как наука Развитие творческих способностей школьников на уроках химии
Развитие творческих способностей школьников на уроках химии Углеводороды. Урок-игра
Углеводороды. Урок-игра Получение антибиотиков
Получение антибиотиков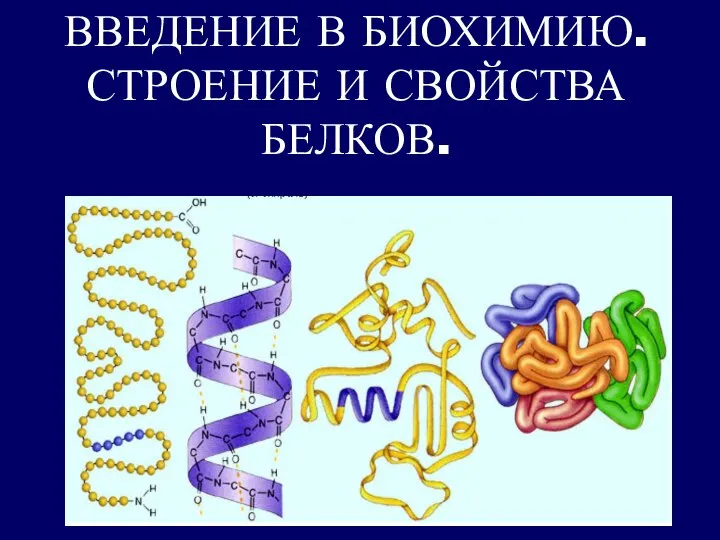 Введение в биохимию. Строение и свойства белков
Введение в биохимию. Строение и свойства белков ДИЕНОВЫЕ УГЛЕВОДОРОДЫ. КАУЧУКИ.
ДИЕНОВЫЕ УГЛЕВОДОРОДЫ. КАУЧУКИ.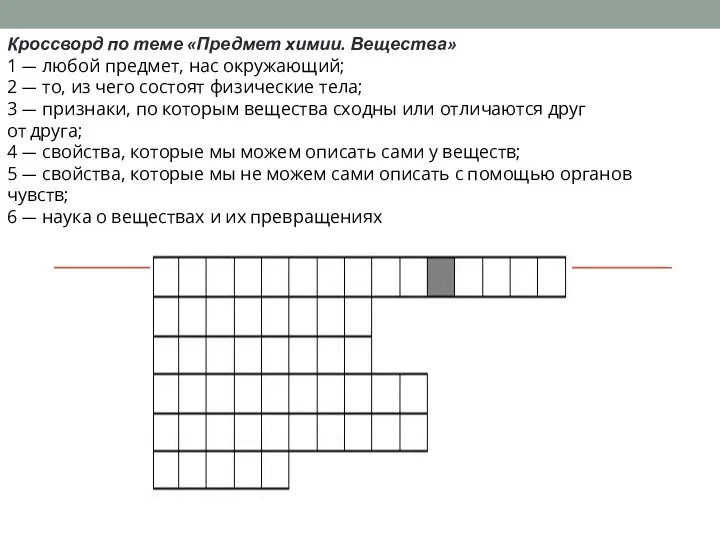 Предмет химии. Вещества
Предмет химии. Вещества Алкины. Ацетилен
Алкины. Ацетилен Юные химики. Своя игра
Юные химики. Своя игра Металлы. Химический хоккей
Металлы. Химический хоккей Основы квантовой химии
Основы квантовой химии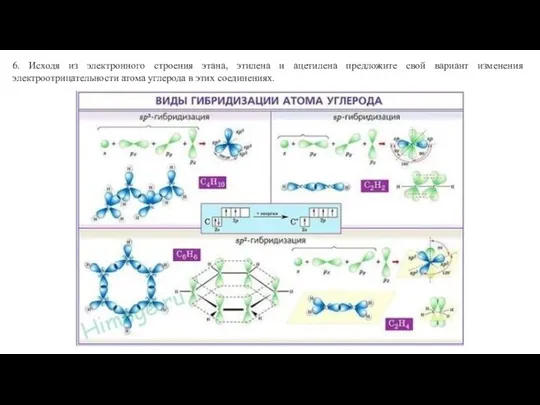 Виды гибридизации атома углерода
Виды гибридизации атома углерода Сплавы. 9 класс
Сплавы. 9 класс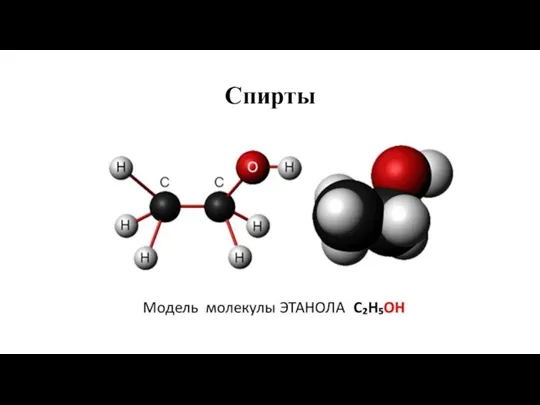 Спирты
Спирты Презентация по Химии "Ковалентная химическая связь"
Презентация по Химии "Ковалентная химическая связь"