Слайд 2Факторы, влияющие на скорость химической реакции
Скорость химических реакций зависит от многих факторов.

Основными из них являются:
природа и концентрация реагирующих веществ,
давление (в реакциях с участием газов),
температура,
действие катализаторов,
поверхность реагирующих веществ в случае гетерогенных реакций.
Слайд 3Скорость реакции
Скорость гомогенной реакции определяется как изменение концентрации одного из

веществ в единицу времени:
υ = ∆ C / ∆ t ( моль/л с )
Скорость гетерогенной реакции определяется как изменение количества вещества в единицу времени на единице поверхности:
υ = ∆ n / ∆t S ( моль/с м2 )
Где S-площадь поверхности соприкосновения веществ ( м2 , см2 )
Слайд 4Зависимость скорости химической реакции от концентрации реагирующих веществ
Зависимость скорости химической реакции

от концентрации реагирующих веществ описывается основным законом химической кинетики – законом действующих масс.
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их коэффициентам в уравнении реакции.
CN2 и CH2 – концентрации азота и водорода (моль/л)
k- коэффициент пропорциональности, называемый константой скорости реакции.
Слайд 5Правило Я.Х. Вант-Гоффа :
Правило Я.Х. Вант - Гоффа :
Повышение температуры на

каждые 10 С приводит к увеличению скорости реакции в 2-4 раза (эту величину называют температурным коэффициентом реакции).
Математически эта зависимость выражается соотношением:
υt2 = υt1 γ 10
υt2 , υt1 – скорости реакции соответственно при конечной t2 и начальной t1 температурах , γ – температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции с повышением температуры на каждые 10 С.
Слайд 6Катализ
Катализаторами называются вещества, не расходующиеся в результате протекания реакции, но влияющие на

её скорость.
Явление изменения скорости реакции под действием таких веществ называется катализом.
Реакции, протекающие под действием катализаторов, называются каталитическими.
В зависимости от агрегатного состояния катализатора и реагирующих веществ различают катализ гомогенный и гетерогенный.
Слайд 7Итог деятельности деловой игры:
-расширены знания о скорости химической реакции и

о факторах, влияющих на неё;
-выявлены «болевые точки» в технологической линии по производству аммиака;
-предложены решения с целью предупреждения кризиса на предприятии.






 Кремневые породы
Кремневые породы Алкены (олефины)
Алкены (олефины) Алканы – строение, химические свойства
Алканы – строение, химические свойства Массовая доля химич элемента
Массовая доля химич элемента Алканы
Алканы Свойства отдельных классов неорганических и органических веществ на примере лекарственных средств
Свойства отдельных классов неорганических и органических веществ на примере лекарственных средств Классификация реагентов и реакции в органической химии
Классификация реагентов и реакции в органической химии Этапы аналитических работ
Этапы аналитических работ Презентация на тему Кремний и его соединения
Презентация на тему Кремний и его соединения  Сравнительная характеристика NO и NO2 (строение молекул, особенности поведения, устойчивость, ОК свойства)
Сравнительная характеристика NO и NO2 (строение молекул, особенности поведения, устойчивость, ОК свойства) Никель и его соединения
Никель и его соединения Каучук
Каучук Химические средства защиты растений
Химические средства защиты растений Техносферная безопасность. Химия как наука
Техносферная безопасность. Химия как наука Развитие творческих способностей школьников на уроках химии
Развитие творческих способностей школьников на уроках химии Углеводороды. Урок-игра
Углеводороды. Урок-игра Получение антибиотиков
Получение антибиотиков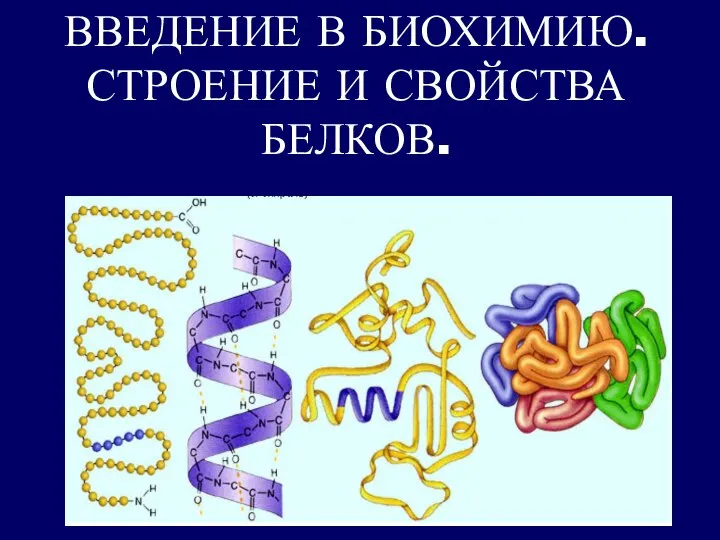 Введение в биохимию. Строение и свойства белков
Введение в биохимию. Строение и свойства белков ДИЕНОВЫЕ УГЛЕВОДОРОДЫ. КАУЧУКИ.
ДИЕНОВЫЕ УГЛЕВОДОРОДЫ. КАУЧУКИ.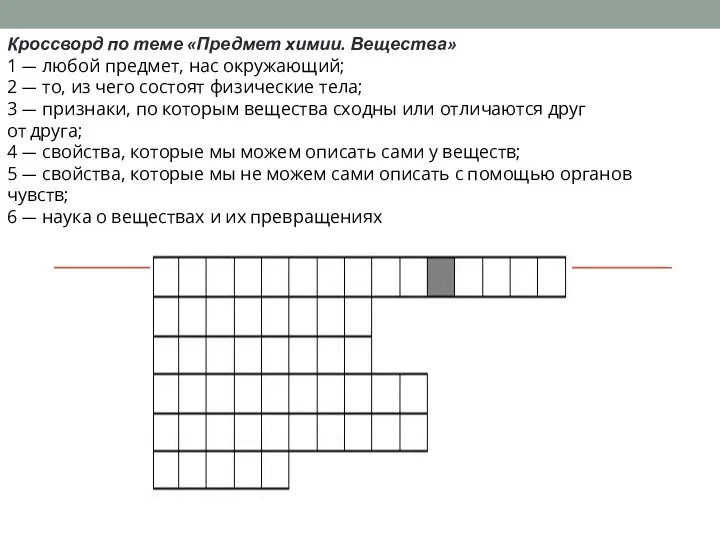 Предмет химии. Вещества
Предмет химии. Вещества Алкины. Ацетилен
Алкины. Ацетилен Юные химики. Своя игра
Юные химики. Своя игра Металлы. Химический хоккей
Металлы. Химический хоккей Основы квантовой химии
Основы квантовой химии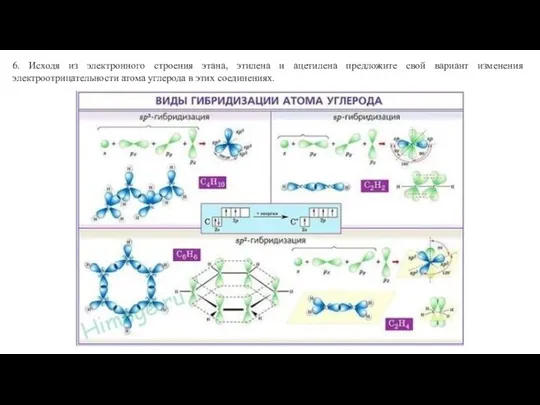 Виды гибридизации атома углерода
Виды гибридизации атома углерода Сплавы. 9 класс
Сплавы. 9 класс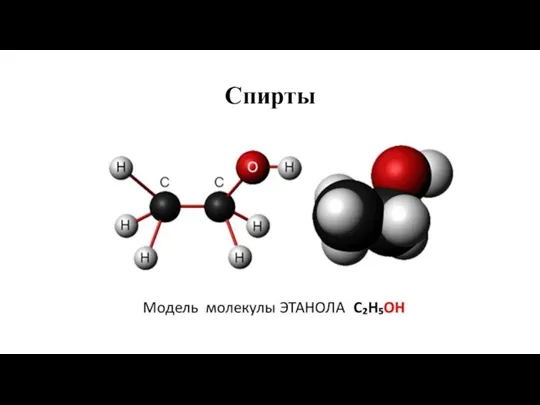 Спирты
Спирты Презентация по Химии "Ковалентная химическая связь"
Презентация по Химии "Ковалентная химическая связь"