Содержание
- 2. Теллур Теллур (лат. Tellurium) — это химический элемент с атомным номером №52 в периодической системе и
- 3. Из истории Впервые был найден в 1782 году в золотоносных рудах Трансильвании горным инспектором Францом Иозефом
- 4. "Аурум парадоксум" - парадоксальное золото, так называли теллур, после того как в конце XVIII столетия он
- 5. Происхождение названия Позднее (1798 г.), когда М. Клапрот детальнее исследовал новое вещество, он в честь Земли,
- 6. Нахождение в природе Содержание в земной коре 1·10-6 % по массе. Металлический теллур можно встретить разве
- 7. Модуль Пельтье Многие знакомы с термоэлектрическими модулями Пельтье, которые используют в портативных холодильниках, термоэлектрических генераторах и
- 8. Физические свойства Теллур серебристо-белого цвета с металлическим блеском, хрупок, при нагреве становится пластичным. Кристаллизуется в гексагональной
- 9. Теллур – неметалл. В соединениях теллур проявляет степени окисления: -2, +4, +6 (валентность II, IV, VI).
- 10. Физиологическое действие При нагревании Теллур взаимодействует с водородом с образованием теллуроводорода - H2Te бесцветного ядовитого газа
- 11. Получение Основной источник — шламы электролитического рафинирования меди и свинца. Шламы подвергают обжигу, теллур остается в
- 13. Скачать презентацию










 Презентация на тему Растворение. Растворы (8 класс)
Презентация на тему Растворение. Растворы (8 класс)  ad8c00e7ea114b35a6fc29426ea31646 (1)
ad8c00e7ea114b35a6fc29426ea31646 (1) Основные классы неорганических соединений
Основные классы неорганических соединений Химия элементов VIA группы
Химия элементов VIA группы Кетоны. Реагирующие вещества
Кетоны. Реагирующие вещества Презентация на тему Алюминий(Al)
Презентация на тему Алюминий(Al)  Химиялық фармацевтикалық техниканың үдерістері
Химиялық фармацевтикалық техниканың үдерістері Удельная теплота сгорания
Удельная теплота сгорания Презентация на тему Почему протекают химические реакции
Презентация на тему Почему протекают химические реакции  Предмет органической химии. Строение атома углерода
Предмет органической химии. Строение атома углерода Строение вещества
Строение вещества Курсовой синтез ацетоуксусного эфира
Курсовой синтез ацетоуксусного эфира Причины протекания химических реакций
Причины протекания химических реакций Синтетические и натуральные краски
Синтетические и натуральные краски Основы химической термодинамики
Основы химической термодинамики Определение понятия сплавов. Сплавы на основе железа и меди
Определение понятия сплавов. Сплавы на основе железа и меди Сухой спирт
Сухой спирт VII Межрегиональная метапредметная конференции Удивительный мир научных книг. Ситуационные задания по химии
VII Межрегиональная метапредметная конференции Удивительный мир научных книг. Ситуационные задания по химии Тема урока: «Свойства тканей из химических волокон»
Тема урока: «Свойства тканей из химических волокон» Кислоты
Кислоты Интеллектуальная игра По страницам истории химии
Интеллектуальная игра По страницам истории химии Аммиак. Строение молекулы. Водородная связь
Аммиак. Строение молекулы. Водородная связь Nanofibers of aluminum oxide
Nanofibers of aluminum oxide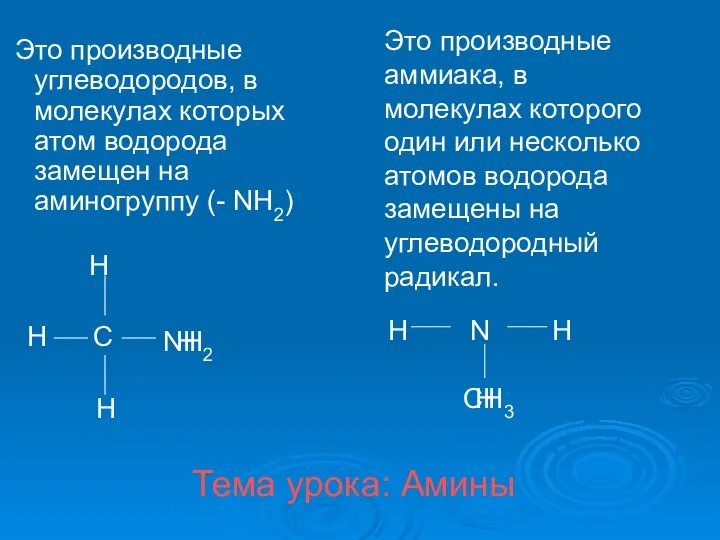 Амины. Классификация аминов
Амины. Классификация аминов Алкалоидтар. Алкалоидтарға жалпы сипаттама, жіктелуінің негізгі принциптері
Алкалоидтар. Алкалоидтарға жалпы сипаттама, жіктелуінің негізгі принциптері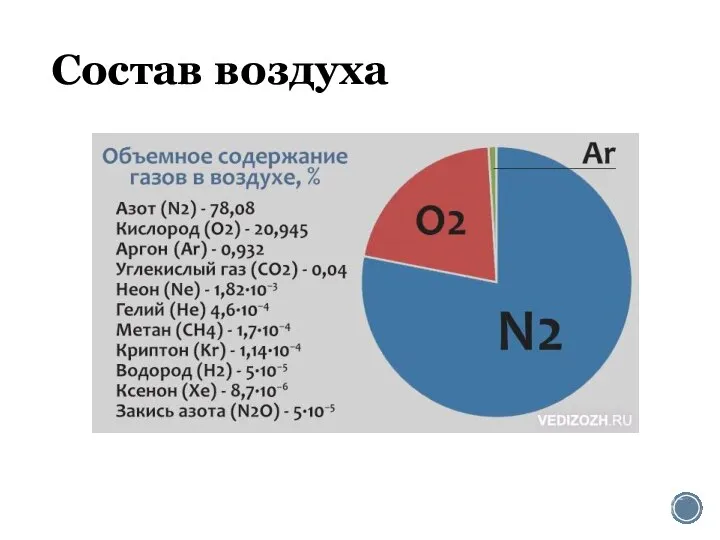 Состав воздуха. Азот
Состав воздуха. Азот Основные понятия химии
Основные понятия химии Реакции ионного обмена
Реакции ионного обмена