Содержание
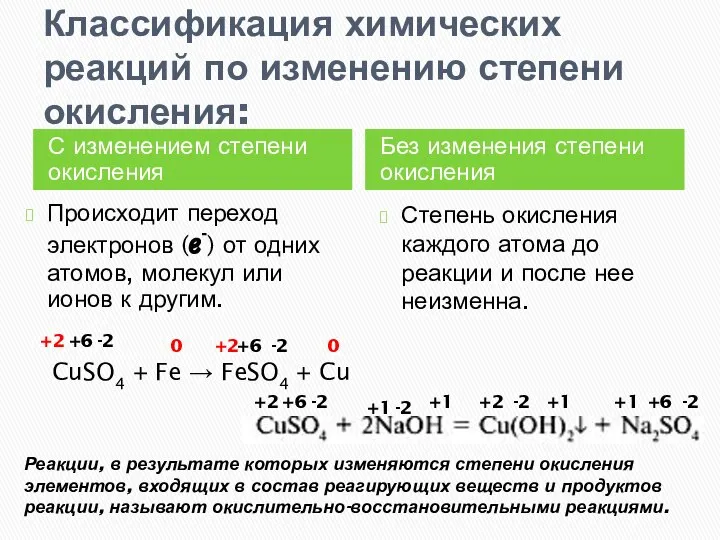
- 2. Классификация химических реакций по изменению степени окисления: С изменением степени окисления Без изменения степени окисления Происходит
- 3. Классификация химических реакций по изменению степени окисления: С изменением степени окисления Без изменения степени окисления Происходит
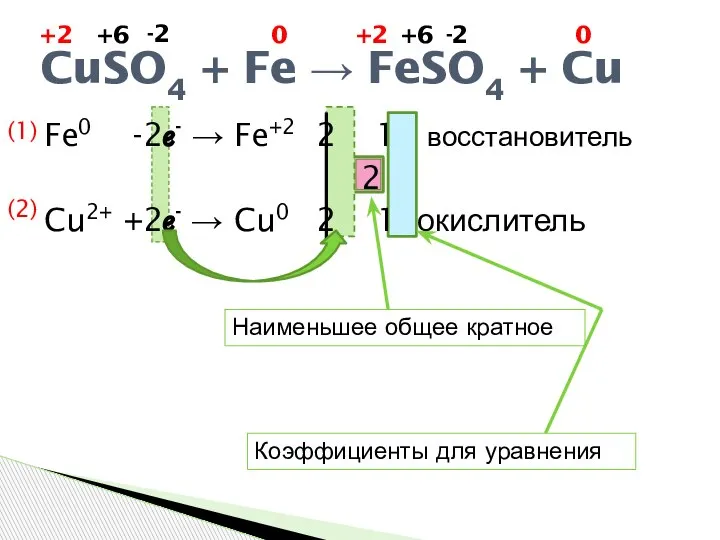
- 4. Fe0 -2ℯ- → Fe+2 2 1 восстановитель 2 Cu2+ +2ℯ- → Cu0 2 1 окислитель CuSO4
- 5. Процесс передачи ℯ- называется окислением. Процесс присоединения ℯ- называется восстановлением. CuSO4 + Fe → FeSO4 +
- 6. Процесс передачи ℯ- называется окислением. Процесс присоединения ℯ- называется восстановлением. CuSO4 + Fe → FeSO4 +
- 7. Атомы, молекулы или ионы, которые отдают ℯ-, называют восстановителями. Атомы, молекулы или ионы, которые присоединяют ℯ-,
- 8. Алгоритм расстановки коэффициентов в уравнениях ОВР методом электронного баланса 1. Определите степени окисления элементов. 2. Подчеркните
- 9. Fe2O3 + CO → Fe + CO2 Расставьте коэффициенты в данной схеме реакции методом электронного баланса,
- 11. Скачать презентацию






 Порядок в жидкостях
Порядок в жидкостях Общая характеристика элементов подгруппы углерода. Углерод – его строение и свойства
Общая характеристика элементов подгруппы углерода. Углерод – его строение и свойства Алмаз Подготовила: УЧЕНИЦА 9 «А» КЛАССА КАЗИЕВА МАРЖАН
Алмаз Подготовила: УЧЕНИЦА 9 «А» КЛАССА КАЗИЕВА МАРЖАН Карбоновые кислоты
Карбоновые кислоты Презентация на тему Валентные состояния атома углерода
Презентация на тему Валентные состояния атома углерода  Роль элементов 5 группы
Роль элементов 5 группы Презентация на тему Уксусная кислота
Презентация на тему Уксусная кислота  Гидролиз солей. Какие типы гидролиза возможны?
Гидролиз солей. Какие типы гидролиза возможны? Выращивание кристаллов соли (домашний эксперимент)
Выращивание кристаллов соли (домашний эксперимент) Белки
Белки Основные классы неорганических веществ
Основные классы неорганических веществ Химическая связь и строение вещества
Химическая связь и строение вещества Смог як хімічне явище
Смог як хімічне явище Презентация на тему Интеллект – мой выбор
Презентация на тему Интеллект – мой выбор  Изучение свойств азотной кислоты для учащихся 9 классов
Изучение свойств азотной кислоты для учащихся 9 классов Стекло. Технология изготовления стекла
Стекло. Технология изготовления стекла Вещество и тело. Атом и молекула. Свойства веществ. Простые и сложные вещества. Химический элемент
Вещество и тело. Атом и молекула. Свойства веществ. Простые и сложные вещества. Химический элемент Гипер-гипофосфатемия
Гипер-гипофосфатемия Алкины
Алкины Оксиды, их классификация. Свойства оксидов в свете теории электролитической диссоциации
Оксиды, их классификация. Свойства оксидов в свете теории электролитической диссоциации Физические и химические свойства алкенов
Физические и химические свойства алкенов Презентация на тему Неорганічні речовини живих організмів
Презентация на тему Неорганічні речовини живих організмів  Единые смеси
Единые смеси Какую воду мы пьем
Какую воду мы пьем Кристаллическое состояние воды - лёд
Кристаллическое состояние воды - лёд Объёмный анализ
Объёмный анализ ліпіди
ліпіди Окислительно-восстановительные реакции
Окислительно-восстановительные реакции