Слайд 2Потенциометрический анализ -
метод определения концентрации ионов, основанный на измерении электрохимического потенциала индикаторного электрода,

погруженного в исследуемый раствор.
Слайд 3Е = Е0 + 0.058lgCМе +n /n
Е = Е0 + 0.058lg([Ok]/[B])/n
![Е = Е0 + 0.058lgCМе +n /n Е = Е0 + 0.058lg([Ok]/[B])/n](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/877443/slide-2.jpg)
Слайд 4Первый вариант
Это измерение потенциала электрода, погруженного в исследуемый раствор, и вычисление концентрации

определяемых ионов по уравнению (1). Можно также пользоваться мембранными ионоселективными электродами. Этот метод получил название прямой потенциометрии.
Слайд 5Второй вариант
Это метод потенциометрического титрования. Сущность метода заключается в том,что в исследуемый

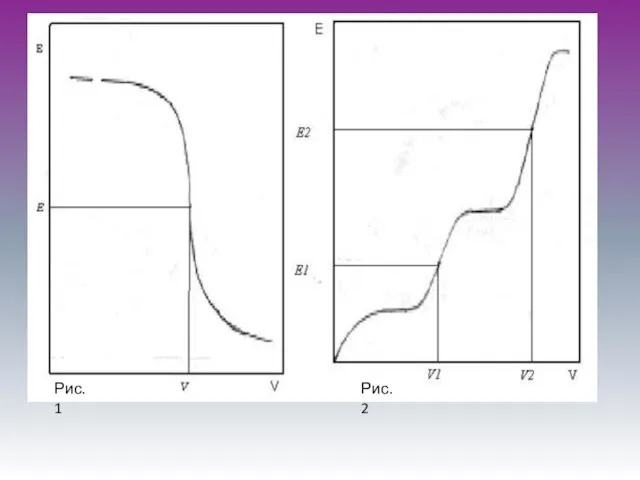
раствор погружают индикаторный электрод и титруют раствор,определяя в процессе титрования потенциал электрода (разность потенциалов между индикаторным электродом и электродом сравнения).В процессе титрования концентрация определяемых ионов изменяется в зависимости от объема прибавленного рабочего раствора неравномерно: сначала это изменение невелико,затем становится более заметным и, наконец,в точке эквивалентности достигает наибольшего значения.При этом потенциал электрода,зависящий от концентрации ионов в растворе,также изменяется,причем максимальное изменение соответствует эквивалентному отношению реагирующих веществ.
Слайд 7Потенциометрическое титрование
Можно титровать окрашенные растворы, когда цветные индикаторы не применимы.
Легко

можно определить, не прибегая к предварительному разделению, несколько веществ в смеси. На кривой титрования получается несколько скачков потенциала, по которым находят объем рабочего раствора, израсходованного на взаимодействие с каждым компонентом сложного раствора.
Слайд 8Классификация потенциометрических методов анализа
1. Методы осаждения и комплексообразования. Примеры: титрование галогенидов нитратом серебра;

титрование катионов меди, цинка, кадмия, свинца, серебра раствором гексацианоферрата; титрование катионов алюминия, бериллия, магния раствором фторида натрия по реакции комплексообразования и др.
2. Методы окисления-восстановления. Примеры: титрование растворами окислителей или восстановителей. Перманаганатометрия,хроматометрия,йодометрия и др.
3. Методы кислотно-основного титрования. Определение слабых и сильных кислот и их солей, когда нельзя применять цветные индикаторы.
Слайд 9Индикаторными электродами
называют электроды, применяемые для определения активности ионов в растворе. Индикаторный электрод

соединяют с другим электродом в гальванический элемент и измеряют разность потенциалов между обоими электродами. Потенциал второго электрода постоянен, его значение известно; такие электроды называют стандартными электродами (электроды сравнения). Измерив разность потенциалов между индикаторным и стандартным электродами и зная потенциал стандартного электрода, можно затем, если необходимо, найти потенциал индикаторного электрода.
Слайд 10Требования
Обратимость, т.е. потенциал электрода должен изменяться с изменением активности (концентрации) ионов в

растворе в соответствии с уравнением Нернста;
Индикаторный электрод должен быть устойчив по отношению к веществам, находящимся в растворе;
Потенциал должен устанавливаться быстро, иначе титрование потребует много времени.
Имеется не много металлических электродов, удовлетворяющих всем этим условиям. Наиболее универсальным и широко применяемым является индифферентный платиновый электрод.

![Е = Е0 + 0.058lgCМе +n /n Е = Е0 + 0.058lg([Ok]/[B])/n](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/877443/slide-2.jpg)






 Кислоты, их состав и название
Кислоты, их состав и название Эквивалент. Закон эквивалентов
Эквивалент. Закон эквивалентов Презентация на тему Химия в криминалистике
Презентация на тему Химия в криминалистике  Понятие биотехнологии
Понятие биотехнологии Взаимодействие элементов-неметаллов между собой. 8 класс
Взаимодействие элементов-неметаллов между собой. 8 класс Презентация на тему Карбонаты
Презентация на тему Карбонаты  Активность каталазы
Активность каталазы Презентация на тему Роль йода в организме
Презентация на тему Роль йода в организме  Классификация неорганических соединений и реакций
Классификация неорганических соединений и реакций Химические реакторы. (Лекция 2)
Химические реакторы. (Лекция 2) Лаборатория мечты
Лаборатория мечты Альдегиды, строение и свойства
Альдегиды, строение и свойства Присоединение аммиака и аминов
Присоединение аммиака и аминов Характеристика щелочных металлов (9 класс)
Характеристика щелочных металлов (9 класс) Опыт тепло и холод. Поглощение тепла и кристаллическая ёлочка
Опыт тепло и холод. Поглощение тепла и кристаллическая ёлочка Ķīmiskais līdzsvars un faktori, kas to ietekmē
Ķīmiskais līdzsvars un faktori, kas to ietekmē Ацетиленовые углеводороды (алкины). Лекция №7
Ацетиленовые углеводороды (алкины). Лекция №7 Презентация на тему "Азотная кислота"
Презентация на тему "Азотная кислота" Основные типы химических реакций
Основные типы химических реакций Кислородсодержащие органические вещества. Тест
Кислородсодержащие органические вещества. Тест Стекло
Стекло Кальций
Кальций Исследование свойств модельной смеси сополимера Акритана-С с ЛД-70
Исследование свойств модельной смеси сополимера Акритана-С с ЛД-70 Уретановый каучук
Уретановый каучук Диеновые углеводороды
Диеновые углеводороды Электронное и пространственное строение молекулы метана Учитель химии МБОУ СОШ № 9 МО ЩР станица Новощербиновская Степучева Ол
Электронное и пространственное строение молекулы метана Учитель химии МБОУ СОШ № 9 МО ЩР станица Новощербиновская Степучева Ол Молибден. Получение молибдена
Молибден. Получение молибдена Презентация на тему Соединения химических элементов
Презентация на тему Соединения химических элементов