Содержание
- 2. Сегодня мы с вами должны вспомнить, чем отличаются жидкости от газов, и узнать, почему вода бывает
- 3. Давайте вспомним: 1.Основной закон, описывающий состояние газов называют законом _______. 2.Один моль любого газа занимает объём
- 4. Проверьте друг друга. 1.Авогадро, 2.22,4 л/моль, 3.Азот, кислород, 4.Озон, 5.Водород, 6.Известняка, 7.Синюю. За каждый правильный ответ
- 5. Попробуй реши: 1 вариант. Задача №1. Какой объём ( при н.у.) будут занимать 2 моль углекислого
- 6. Сверьте ответы… 1 Вариант Задача №1. Ответ: 44,8 л (1 Б) Задача №2. Ответ:661,8 л.(2Б) 2
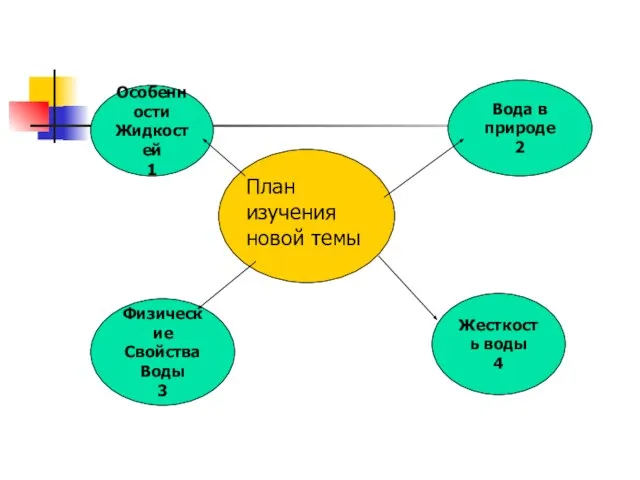
- 7. План изучения новой темы Физические Свойства Воды 3 Особенности Жидкостей 1 Жесткость воды 4 Вода в
- 8. Особенности жидкого состояния вещества. 1.Молекулы находятся непосредственно друг возле друга, поэтому жидкости – малосжимаемы, в отличие
- 9. Вода в природе. Важнейшим жидким веществом является вода, которая покрывает 2/3 поверхности Земли. 97,2 % общего
- 10. Чем уникальна вода? Физические свойства воды обусловлены строением её молекул, а также межмолекулярными связями. Молекулы воды
- 11. Вода имеет аномально высокую температуру плавления и кипения. Сравните молекулярные массы воды и других гидридов элементов
- 12. Ещё одна аномалия воды: Лёд благодаря водо- родным связям имеет ячеистое строение и поэтому легче воды.
- 13. Бывает ли вода «жесткой»? Жесткость природных вод может меняться в зависимости от года: она понижается зимой,
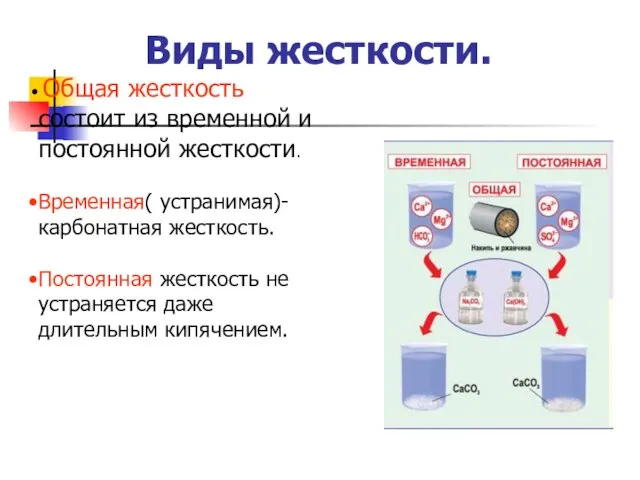
- 14. Виды жесткости. Общая жесткость состоит из временной и постоянной жесткости. Временная( устранимая)- карбонатная жесткость. Постоянная жесткость
- 15. ВИДЫ ЖЕСТКОСТИ. КАРБОНАТНАЯ жесткость зависит от содержания в воде гидрокарбонатов кальция и магния Са(НСО3)2, Mg(HCO3)2. Некарбонатная
- 16. Что такое «жесткая» вода? Жесткая вода- это накипь на деталях бытовой техники , стенках котлов и
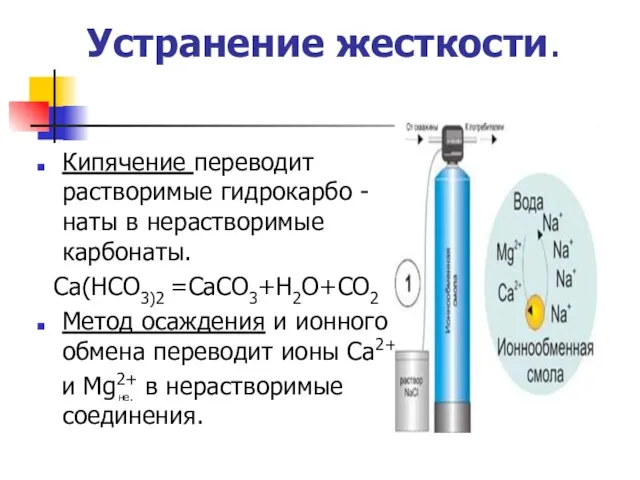
- 17. Устранение жесткости. Кипячение переводит растворимые гидрокарбо -наты в нерастворимые карбонаты. Са(НСО3)2 =СаСО3+Н2О+СО2 Метод осаждения и ионного
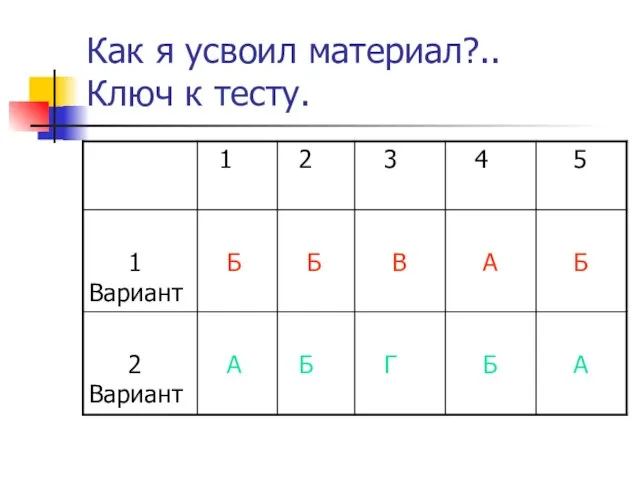
- 18. Как я усвоил материал?.. Ключ к тесту.
- 19. Подведем итоги. Подсчитайте свои баллы (каждый правильный ответ теста- 1балл) Поставьте себе оценку: 12-11 баллов- «пять»
- 20. Если Вы получили: «5»-§ 9, №11, кроссворд; «4»-§ 9, № 7,10; «3»-§ 9, № 1,3, повторить
- 22. Скачать презентацию















 Приходченко ФЕР-2031
Приходченко ФЕР-2031 Строение органических веществ
Строение органических веществ Изомерия
Изомерия Современная ВЭЖХ. Круг анализируемых объектов. Сорбенты и подвижные фазы для ВЭЖХ. (Лекция 2)
Современная ВЭЖХ. Круг анализируемых объектов. Сорбенты и подвижные фазы для ВЭЖХ. (Лекция 2) Что такое бинарные соединения?
Что такое бинарные соединения? Теория растворов. (Тема 1.5)
Теория растворов. (Тема 1.5) Аминокислоты и белки. Химия
Аминокислоты и белки. Химия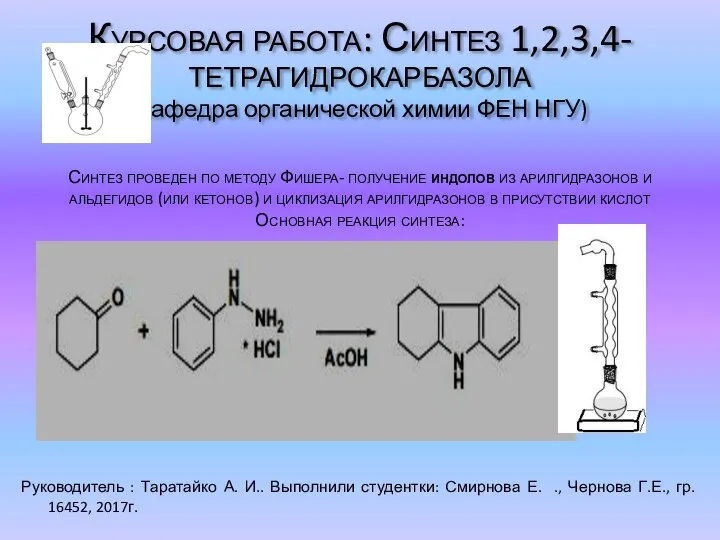 Синтез 1,2,3,4-тетрагидрокарбазола
Синтез 1,2,3,4-тетрагидрокарбазола Биологическое значение брома и йода
Биологическое значение брома и йода Типы химических реакций
Типы химических реакций Химия и космос
Химия и космос Фараонова Змея
Фараонова Змея Взаимодействие кислот с металлами. Кислоты-окислители
Взаимодействие кислот с металлами. Кислоты-окислители Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады) Кальций и его соединения. 9 класс
Кальций и его соединения. 9 класс Ода стеклу и городу-герою Керчи
Ода стеклу и городу-герою Керчи Физические свойства
Физические свойства Кислоты. Состав, названия и классификация
Кислоты. Состав, названия и классификация Энергетические уровни
Энергетические уровни Мономеры
Мономеры Металлы. Свойства металлов
Металлы. Свойства металлов Контрольная работа №1
Контрольная работа №1 Генетичні зв’язки між неорганічними речовинами
Генетичні зв’язки між неорганічними речовинами Интересные свойства пластика
Интересные свойства пластика Классификация неорганических веществ. Оксиды
Классификация неорганических веществ. Оксиды Презентация на тему Дисперсные системы (11 класс)
Презентация на тему Дисперсные системы (11 класс)  Расчет равновесного состояния системы натрий-кислород-водород, для энергетических ядерных реакторов
Расчет равновесного состояния системы натрий-кислород-водород, для энергетических ядерных реакторов Способы очистки питьевой воды
Способы очистки питьевой воды