Слайд 2Алканы
Алканы – это углеводороды линейного или разветвлённого строения, содержащие только простые связи

и образующие гомологический ряд с общей формулой CnH2n+2.
Алканы являются насыщенными углеводородами и содержат максимально возможное число атомов водорода.
Простейшим представителем класса является метан (CH4).
Углеводород с самой длинной цепью — нонаконтатриктан.
Слайд 3Этан
Этан – органическое соединение, второй член гомологического ряда алканов.
Химическая формула - C2H6.
Интересный

факт:
Предположительно, на поверхности Титана (спутник Сатурна) в условиях низких температур (−180 °C) существуют целые озёра и реки из жидкой метано-этановой смеси!
Слайд 4Этан
Физические свойства при нормальных условиях:
Бесцветный газ, не имеет запаха и вкуса;
Молярная масса

– 30,07:
Температура плавления – 182,81°С;
Температура кипения – 88,63°С;
Нерастворим в воде;
Обладает слабым наркотическим и галлюциногенным действием.
Слайд 5Этан
Химические свойства:
Термическое дегидрирование этана при 550—650 °С приводит к этилену;
при температурах свыше

800 °С — к ацетилену (образуются также бензол и сажа);
Прямое хлорирование при 300—450 °С — к этилхлориду;
Нитрование в газовой фазе даёт смесь (3:1) нитроэтана и нитрометана.
Слайд 6Этан
Получение в промышленности:
Этан получают из нефтяных и природных газов, где он составляет

до 10 % по объёму. В России содержание этана в нефтяных газах очень низкое. В США и Канаде (где его содержание в нефтяных и природных газах высоко) служит основным сырьём для получения этилена.
Слайд 7Этан
Получение в лабораторных условиях этан получают из:
иодметана по реакции Вюрца;
из ацетата натрия

электролизом по реакции Кольбе, сплавлением пропионата натрия с щёлочью;
из этилбромида по реакции Гриньяра, гидрированием этилена (над Pd) или ацетилена (в присутствии никеля Ренея).
Слайд 8Этан
Применение:
Основное использование этана в промышленности – получение этилена.
Существует возможность использования этана как

сырья для пиролиза (Пиро́лиз — термическое разложение органических и многих неорганических соединений. В узком смысле — разложение органических природных соединений при недостатке кислорода (древесины, нефтепродуктов и прочего).
Как сырье для получения ценных кислородсодержащих соединений.
Слайд 9источники
ru.solverbook.com/spravochnik/ximiya/soedineniya/etan/
https://ru.wikipedia.org/wiki/Этан
https://ru.wikipedia.org/wiki/Алканы
https://dic.academic.ru/dic.nsf/ruwiki/13828#.D0.A5.D0.B8.D0.BC.D0.B8.D1.87.D0.B5.D1.81.D0.BA.D0.B8.D0.B5









 1
1 Алкены (этиленовые углеводороды)
Алкены (этиленовые углеводороды) Природа и классификация химических связей
Природа и классификация химических связей Методы активации карбоксильной группы
Методы активации карбоксильной группы Химическая промышленность. Аварии на химических предприятиях
Химическая промышленность. Аварии на химических предприятиях bc95487a97b0472591b20aef8d569081
bc95487a97b0472591b20aef8d569081 Сплавы металлов (познавательная презентация)
Сплавы металлов (познавательная презентация) Адиабатическое приближение, потенциальные поверхности молекулярных систем, неадиабатические переходы
Адиабатическое приближение, потенциальные поверхности молекулярных систем, неадиабатические переходы Фторопласты и их использование
Фторопласты и их использование Адсорбция. Механизмы адсорбции. Термодинамика адсорбции. Лекция 5
Адсорбция. Механизмы адсорбции. Термодинамика адсорбции. Лекция 5 Графический диктант. Азот и Аммиак
Графический диктант. Азот и Аммиак Флэшмоб: Лаборатория на кухне
Флэшмоб: Лаборатория на кухне Процессы переработки нефти
Процессы переработки нефти Общие вопросы материаловедения
Общие вопросы материаловедения Электрохимическая коррозия
Электрохимическая коррозия Циклоалканы (полиметиленовые, циклопарафины, ациклические)
Циклоалканы (полиметиленовые, циклопарафины, ациклические) Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции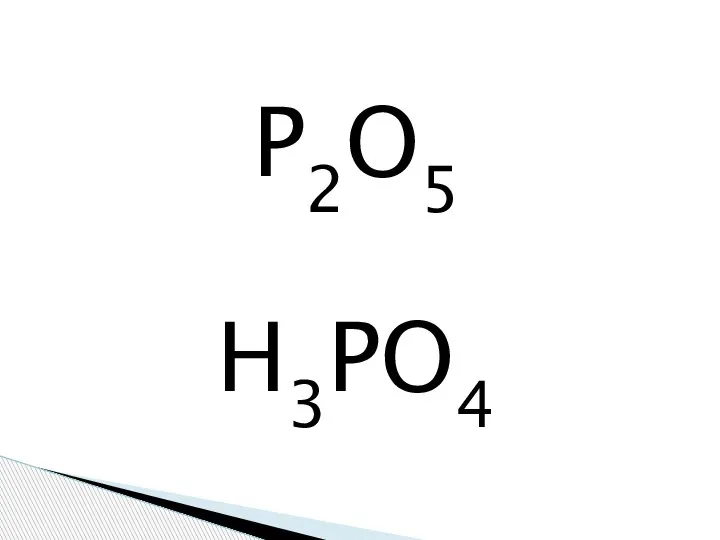 Фосфорная кислота
Фосфорная кислота Пусть имя Д.И. Менделеева будет нашей путеводной звездой
Пусть имя Д.И. Менделеева будет нашей путеводной звездой Вода И её значение
Вода И её значение Презентация на тему Производство стекла
Презентация на тему Производство стекла  Генетическая связь веществ. Виды реакций
Генетическая связь веществ. Виды реакций Понятие о химической реакции. Реакции, идущие без изменения состава веществ
Понятие о химической реакции. Реакции, идущие без изменения состава веществ Атом. Изотопы
Атом. Изотопы Химическая связь (лекция 4)
Химическая связь (лекция 4) Молекулы. Свойства молекул
Молекулы. Свойства молекул Химия, химия, химия!
Химия, химия, химия! Магний и его сплавы
Магний и его сплавы