Содержание
- 2. Определение Спирты – это производные углеводородов, содержащие в молекуле одну или несколько гидроксильных групп – OH
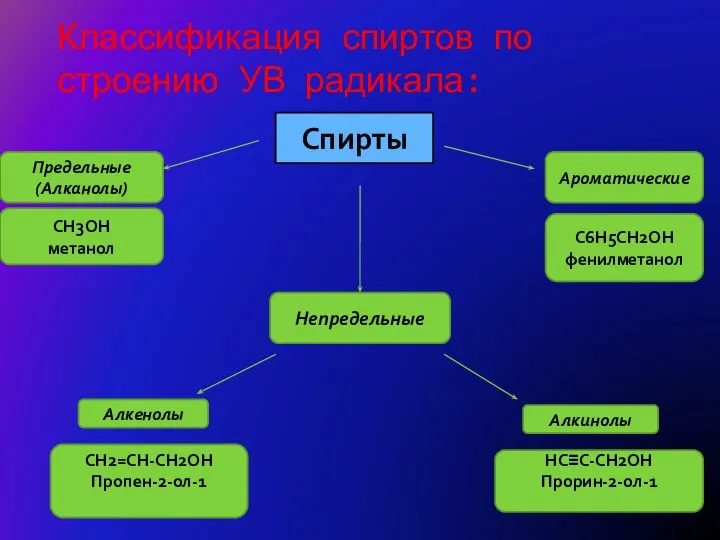
- 3. Классификация спиртов по строению УВ радикала: Спирты Ароматические Предельные (Алканолы) CH3OH метанол C6H5CH2OH фенилметанол Непредельные Алкенолы
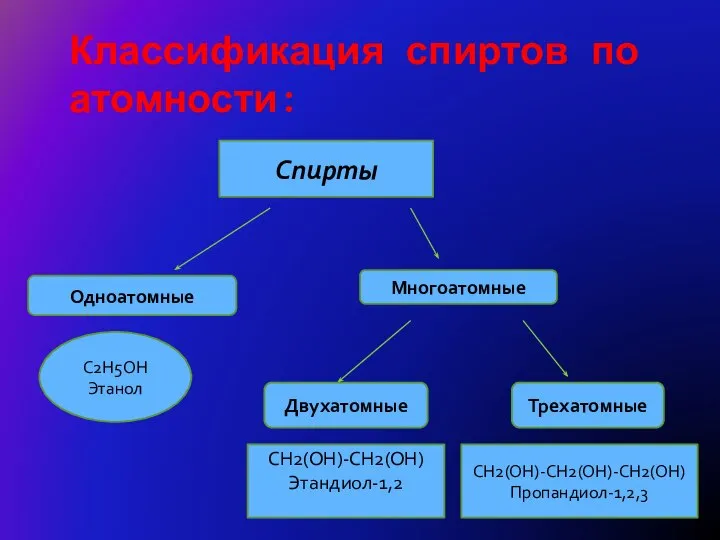
- 4. Классификация спиртов по атомности: Спирты Многоатомные Одноатомные C2H5OH Этанол Двухатомные Трехатомные CH2(OH)-CH2(OH) Этандиол-1,2 CH2(OH)-CH2(OH)-CH2(OH) Пропандиол-1,2,3
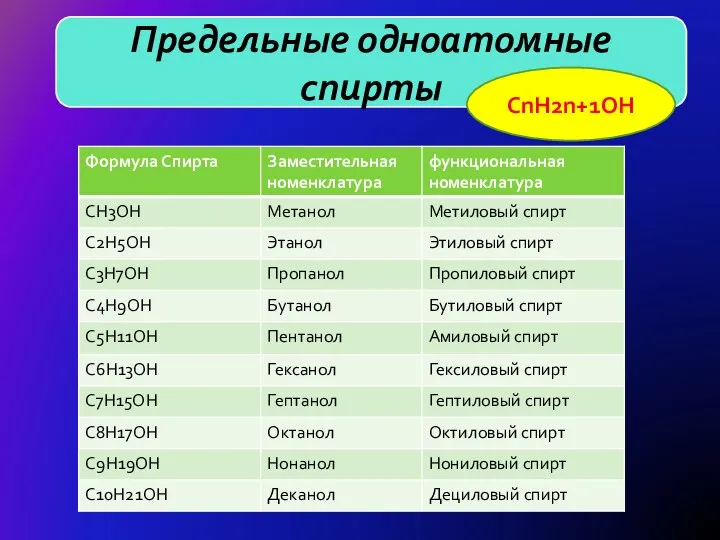
- 5. H Предельные одноатомные спирты CnH2n+1OH
- 6. Изомерия и номенклатура: Название спиртов включает в себя наименование соответствующего углеводорода с добавлением суффикса -ол (положение
- 7. Изомерия Для спиртов характерна структурная изомерия: 1) изомерия положения ОН-группы (начиная с С3); 2) углеродного скелета
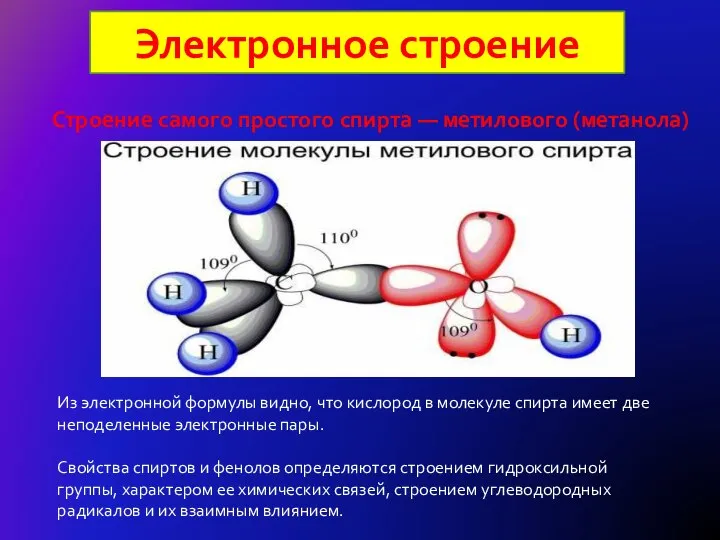
- 8. Электронное строение Строение самого простого спирта — метилового (метанола) Из электронной формулы видно, что кислород в
- 9. Физические свойства спиртов Предельные одноатомные спирты от C1 до C12 — жидкости. Высшие спирты — мазеобразные
- 10. Химические свойства Свойства спиртов ROH определяются наличием полярных связей Oδ-–Hδ+ и Cδ+–Oδ-, и неподеленных электронных пар
- 11. Реакции с разрывом связи RO–H 1) - Спирты реагируют с щелочными и щелочноземельными металлами, образуя солеобразные
- 12. Окисление спиртов: 1) Под действием мягкого окислителя (CuO)первичные спирты окисл. в альдегиды, вторичные в кислоты, третичные
- 13. При полном окислении спиртов 1) Взаимодействие с кислотой с образованием сложного эфира (Реакция Этерефикации) Взаимодействие с
- 14. 2.Гидратация алкенов (согласно правилу В.В. Марковникова): СH3–СH=CH2 + H2O ––H+→ СH3–CH– СH3 I OH 3. Спирты
- 15. 6.Межмолекулярная дегидратация: R--OH + H--O–R –– t°,H2SO4→ R–O–R(простой эфир) + H2O
- 16. Получение В промышленности. Метанол синтезируют из синтез-газа на катализаторе (ZnO, Сu) при 250°C и давлении 5-10
- 17. В лаборатории. Гидратация алкенов (согласно правилу В.В. Марковникова): СH3–СH=CH2 + H2O ––H+→ СH3–CH– СH3 I OH
- 18. Восстановление карбонильных соединений: Альдегиды образуют первичные спирты, а кетоны – вторичные. O II СH3–СH2 – C
- 19. Межмолекулярная дегидратация даёт простые эфиры R--OH + H--O–R –– t°,H2SO4→ R–O–R(простой эфир) + H2O CH3–CH2--OH +
- 21. Скачать презентацию














 Кислоты
Кислоты Метанол. Способы получения
Метанол. Способы получения Расшифровка структуры гликозидов
Расшифровка структуры гликозидов Спирты
Спирты Моноенаминирование 4-пиронов и 4-метилен-4н-пиранов
Моноенаминирование 4-пиронов и 4-метилен-4н-пиранов Все о пище с точки зрения химии
Все о пище с точки зрения химии Соединения Ca и Mg, представителей элементов II группы главной подгруппы
Соединения Ca и Mg, представителей элементов II группы главной подгруппы Слабые и сильные электролиты
Слабые и сильные электролиты Изомерия. Упрощенная классификация органических соединений
Изомерия. Упрощенная классификация органических соединений Художественная обработка металла
Художественная обработка металла Презентация на тему Гидролиз
Презентация на тему Гидролиз  Циклоалканы
Циклоалканы Бораны и карбораны
Бораны и карбораны Из опыта формирования и развития универсальных учебных действий при изучении темы Неметаллы
Из опыта формирования и развития универсальных учебных действий при изучении темы Неметаллы Классификация химических реакций
Классификация химических реакций Валентность химических элементов
Валентность химических элементов Определение времени прохождения диффузии
Определение времени прохождения диффузии Дзержинский политехнический институт. Отчет о работе химической школы
Дзержинский политехнический институт. Отчет о работе химической школы Химическая кинетика
Химическая кинетика 10В Циклоалканы (1)
10В Циклоалканы (1) Оксидті шикізаттан темір ұнтағын алу технологиясын жасау
Оксидті шикізаттан темір ұнтағын алу технологиясын жасау Взаимодействие карбонатов с разбавленными кислотами. Качественные реакции на карбонаты
Взаимодействие карбонатов с разбавленными кислотами. Качественные реакции на карбонаты Презентация на тему Щелочноземельные металлы
Презентация на тему Щелочноземельные металлы  Химико-аналитический контроль
Химико-аналитический контроль Типы химических связей
Типы химических связей Свойства Н2
Свойства Н2 Д-5 Альдегидтер
Д-5 Альдегидтер Мыла и синтетические
Мыла и синтетические