Содержание
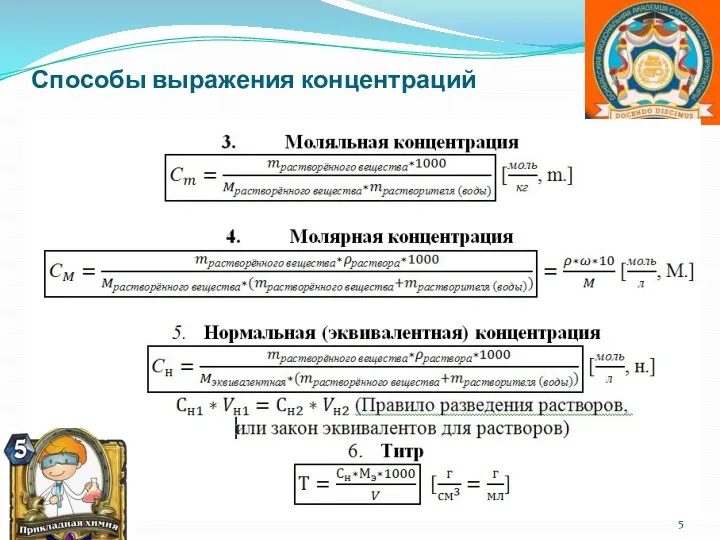
- 4. Способы выражения концентраций
- 5. Способы выражения концентраций
- 6. Способы выражения концентраций
- 7. Способы выражения концентраций
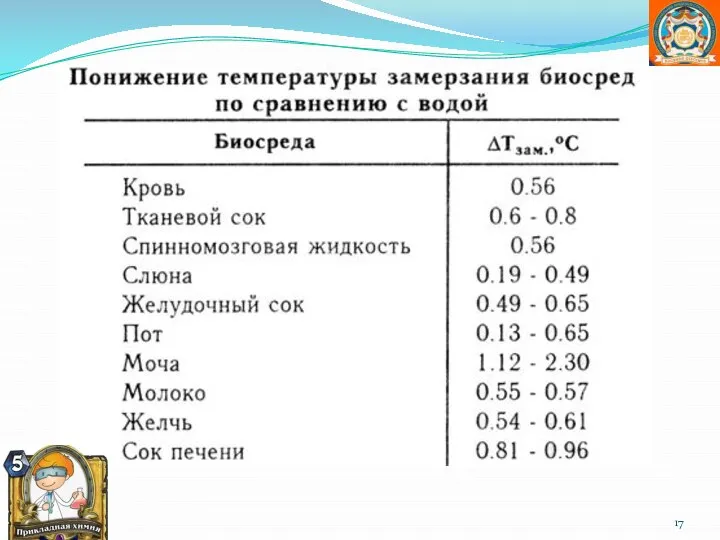
- 8. Коллигативные свойства растворов
- 9. Якоб Хендрик Вант-Гофф (нидерл. Jacobus Henricus (Henry) van 't Hoff; 30 августа 1852, Роттердам — 1
- 10. Осмотическое давление – это давление, которое нужно приложить, чтобы привести раствор в равновесие с чистым растворителем,
- 11. Закон Вант – Гоффа π = См R T П – осмотическое давление (кПа) R –
- 12. i показывает, во сколько раз истинная концентрация кинетически активных частиц в растворе электролита больше, чем в
- 13. Франсуа Мари Рауль (фр. François-Marie Raoult; 10 мая 1830, Фурн-ан-Веп, Нор, — 1 апреля 1901, Гренобль)
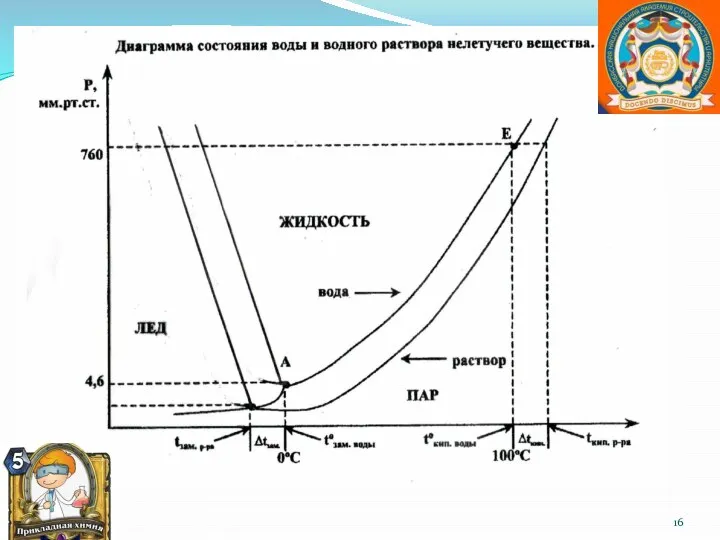
- 14. Закон Рауля (1886) Относительное понижение давления насыщенного пара растворителя над раствором нелетучего неэлектролита пропорционально мольной доле
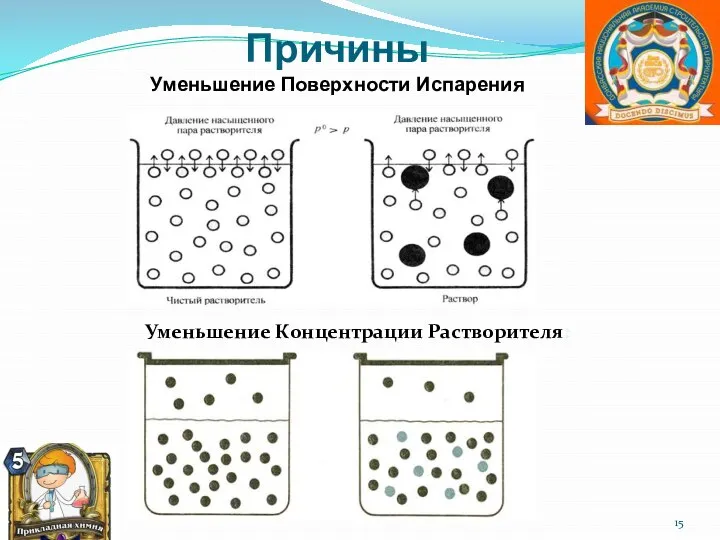
- 15. Причины Уменьшение Поверхности Испарения Уменьшение Концентрации Растворителя:
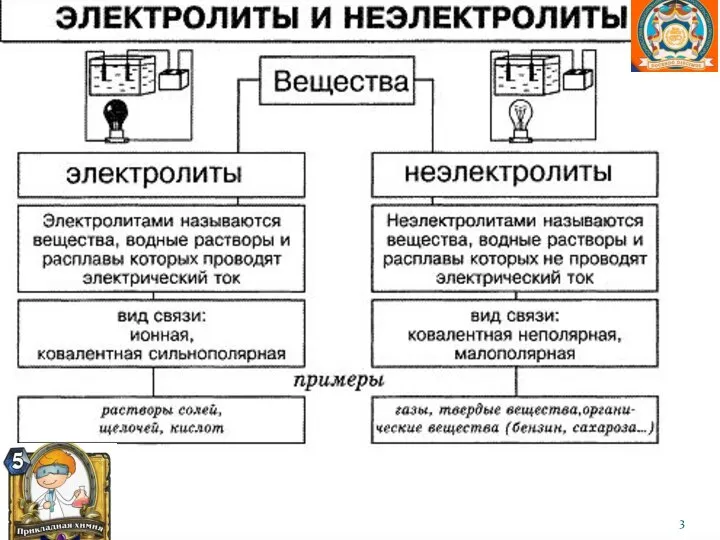
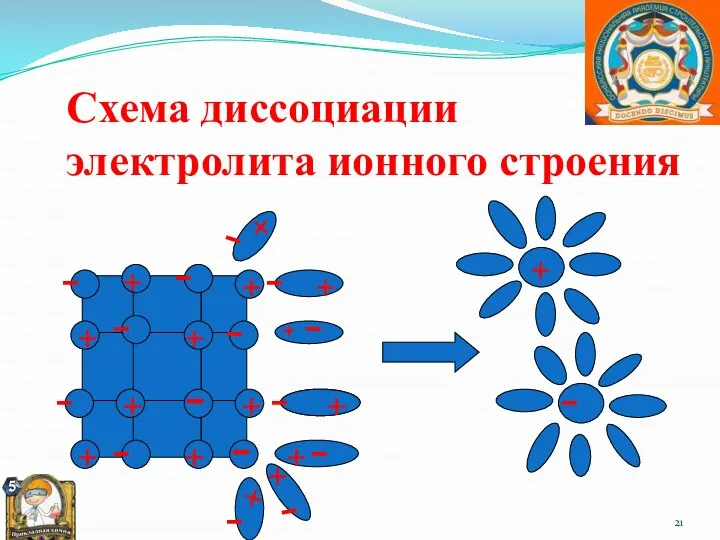
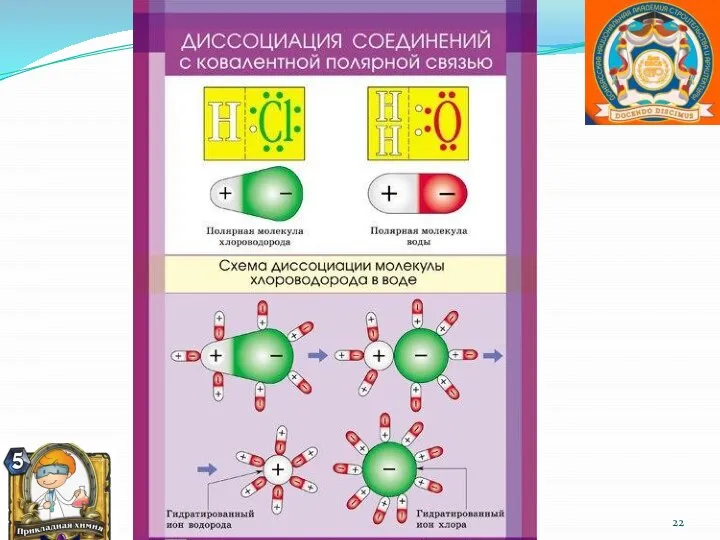
- 18. Электролиты – это вещества, способные в растворах и расплавах диссоциировать на ионы. К ним относятся соединения
- 19. Сванте Аррениус (1859-1927) Шведский физико-химик, основные работы которого посвящены учению о растворах электролитов и кинетике химических
- 20. C продиссоциированных = _________________ C всех молекул Степень диссоциации α зависит от: Природы растворителя и растворенного
- 21. Схема диссоциации электролита ионного строения + + + + + + + + - - -
- 23. Условия протекания реакции образование осадка образование газообразного продукта реакции образование более слабого электролита, чем исходные вещества:
- 26. Теория слабых электролитов К слабым электролитам относятся ковалентные соединения, обратимо (частично) диссоциирующие в водных растворах. К
- 27. Классификация кислот
- 28. Н2О = Н+ + ОН- Константа диссоциации – константа равновесия кН2О = Константа диссоциации К зависит
- 29. Слабые электролиты подчиняются закону разбавления Оствальда, получившего Нобелевскую премию в 1909 за работы в области химического
- 30. При α Вывод закона разбавления Оствальда
- 34. Скачать презентацию















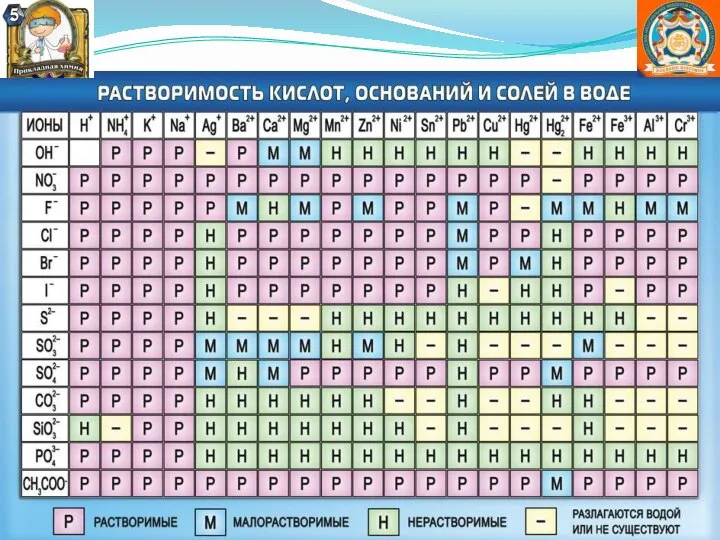





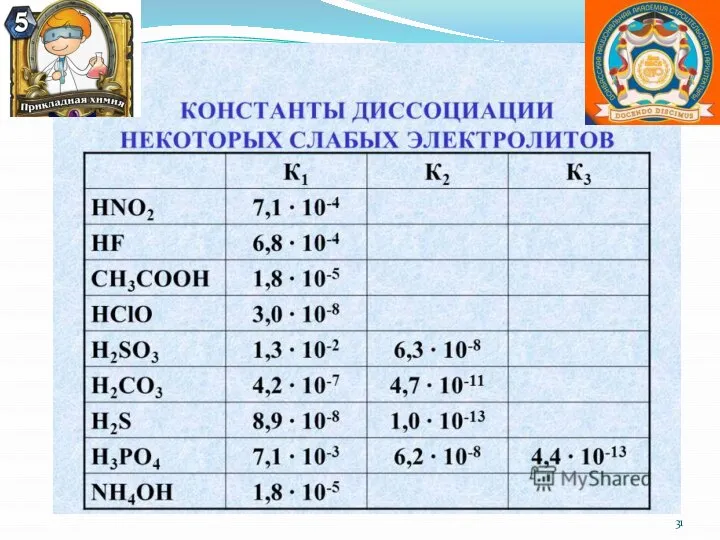

 Валентность
Валентность Аналитическая химия. Введение
Аналитическая химия. Введение Молекулярная струйная печать
Молекулярная струйная печать gidroliz_soley (1)
gidroliz_soley (1) Калифорний Cf
Калифорний Cf Железо
Железо Металлы
Металлы Круговорот азота
Круговорот азота Жиры. Классификация
Жиры. Классификация Получение и химические свойства металлов
Получение и химические свойства металлов Оксиды. Классификация оксидов
Оксиды. Классификация оксидов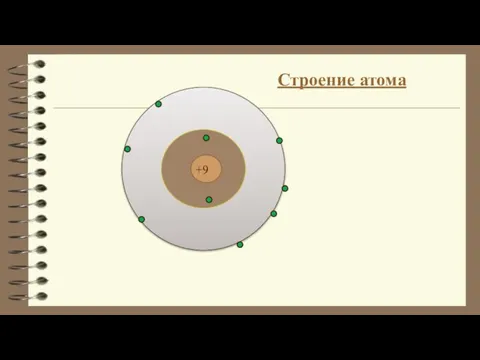 Строение атома
Строение атома Нефть
Нефть Квантовая химия
Квантовая химия Явление когда один элемент образует несколько простых веществ - аллотропия
Явление когда один элемент образует несколько простых веществ - аллотропия Презентация на тему Радиация и её воздействие на человека
Презентация на тему Радиация и её воздействие на человека  К 180-летию со дня рождения Д.И. Менделеева
К 180-летию со дня рождения Д.И. Менделеева Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Классификация реакций
Классификация реакций Презентация на тему Общая характеристика галогенов
Презентация на тему Общая характеристика галогенов  Особенности строения вещества. Лекция №2. Строение кристаллов
Особенности строения вещества. Лекция №2. Строение кристаллов Влияние различных факторов на скорость химических реакций
Влияние различных факторов на скорость химических реакций Хром. Месторождения
Хром. Месторождения Получение аминов
Получение аминов Классификация неорганических соединений
Классификация неорганических соединений Новое в ЕГЭ. Химия
Новое в ЕГЭ. Химия Получение этилового спирта из древесины
Получение этилового спирта из древесины Металлы. Физические свойства металлов
Металлы. Физические свойства металлов