Содержание
- 2. 1. Какие два вида явлений вы знаете? 2. Какие явления называются физическими? Приведите примеры. 3. Какие
- 3. Лабораторный опыт Разложение гидроксида меди (II) Возьмите пробирку с гидроксидом меди (II). Закрепите пробирку в держателе.
- 4. Сколько веществ вступило в реакцию? 2. Сколько веществ образовалось? 3. Какие признаки химических реакций вы наблюдаете?
- 5. 1. Что общего в этих химических реакциях? 2. Сформулируйте определение понятия «реакция разложения». 3. Запишите определение
- 6. Реакции происходят: С малой скоростью при образовании сталактитов и сталагмитов Со средней скоростью при варке пищи
- 7. Допишите предложения: Скорость химической реакции – это _________________________ Катализатор – это _________________________________________ Фермент – это ___________________________________________
- 8. Из предложенных ниже уравнений химических реакций выберите те, которые относятся к реакциям разложения: а) HgO =
- 9. Соотнесите левые и правые части уравнений реакций. Расставьте коэффициенты: H2SiO3 → NaNO3 → NaHCO3 → C2H6
- 11. Скачать презентацию








 Пропиловый спирт C3H7OH
Пропиловый спирт C3H7OH Цветные опыты
Цветные опыты Основания
Основания Общая характеристика нефти и газа
Общая характеристика нефти и газа Соли. Классификация солей
Соли. Классификация солей Карбоновые кислоты
Карбоновые кислоты Концентрированная серная кислота
Концентрированная серная кислота Метаболизм азота
Метаболизм азота Простые вещества – металлы. Физические свойства металлов. Сплавы
Простые вещества – металлы. Физические свойства металлов. Сплавы Презентация на тему Многообразие карбоновых кислот
Презентация на тему Многообразие карбоновых кислот  Вторичная переработка нефти. Крекинг
Вторичная переработка нефти. Крекинг Углерод и наше здоровье
Углерод и наше здоровье Аппаратура ионообменных процессов
Аппаратура ионообменных процессов Теория строения химических соединений
Теория строения химических соединений Контрольна робота, хімія
Контрольна робота, хімія Азот
Азот Санитарно-гигиенические показатели питьевой воды
Санитарно-гигиенические показатели питьевой воды Кислоты. Строение, классификации и свойства неорганических кислот
Кислоты. Строение, классификации и свойства неорганических кислот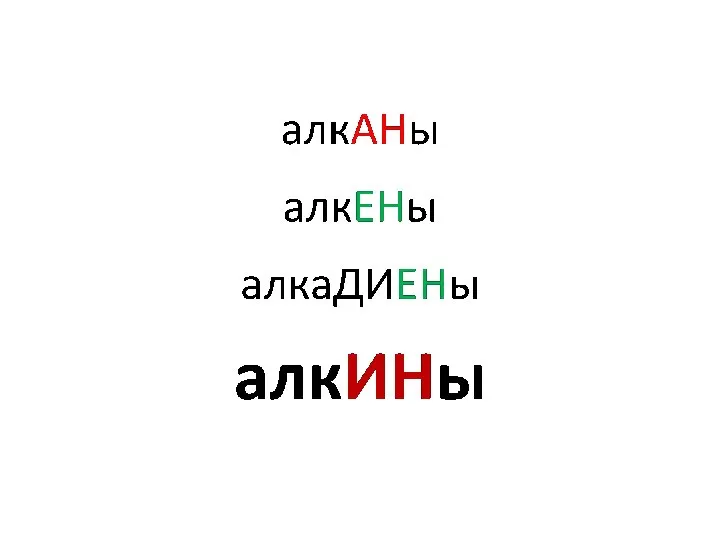 Алкины
Алкины Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Основные понятия химии
Основные понятия химии Гидролиз солей. Какие типы гидролиза возможны?
Гидролиз солей. Какие типы гидролиза возможны? Предмет химии. Вещества
Предмет химии. Вещества Особенности формирования естественно-научной картины мира на уроках географии и химии
Особенности формирования естественно-научной картины мира на уроках географии и химии Презентация на тему Неорганические и органические основания
Презентация на тему Неорганические и органические основания  Стелс-материалы
Стелс-материалы Окислительно-восстановительные реакции. Классификация ОВР
Окислительно-восстановительные реакции. Классификация ОВР Гордость земли Большемурашкинской: Владимир Васильевич Марковников
Гордость земли Большемурашкинской: Владимир Васильевич Марковников