Слайд 2Соли – это химические соединения, состоящие из катионов и анионов. Могут быть получены

при взаимодействии кислот и оснований с выделением воды
Слайд 3КЛАССИФИКАЦИЯ СОЛЕЙ
Средние соли – продукты полного замещения атомов водорода в кислоте химическим

элементом металлом (состоят из катионов металла и анионов кислотного остатка)
Na2SO4, K3PO4
Кислые соли - продукты неполного замещения атомов водорода в кислоте химическим элементом металлом (в анион кислотного остатка входит водород)
NaHSO4, K2HPO4
Основные соли - продукты неполного замещения гидроксогрупп в гидроксиде металла кислотными остатками (катион содержит гироксогруппы)
CuOHCl, AlOH(NO3)2
Слайд 4КЛАССИФИКАЦИЯ СОЛЕЙ
Двойные соли – соли, содержащие два катиона
KAl(SO4)2
Смешанные соли – соли,

содержащие два аниона
CaOCl2
Комплексные соли – соли, содержащие ион комплексообразователя, связанный с лигандами
Na[Al(OH)4]
Слайд 5ЗАДАНИЕ 1 ( ПИСЬМЕННО)
К средним солям относится каждое из двух веществ
Fe(OH)2Cl и

Fe(HSO4)2
MgCl2 и Mg(OH)NO3
KHCO3 и NaHSiO3
K3PO4 и BaSiO3
Слайд 6ЗАДАНИЕ 2 (ПИСЬМЕННО)
Установите соответствие между формулой соли и её принадлежностью к определённой

группе.
А) ZnSO4 1) кислая
Б) Cu2(OH)2CO3 2) средняя
В) KAl(SO4)2 3)основная
Г) NaHSO4 4) двойная
5)комплексная
Слайд 7ЗАДАНИЕ 3 (ПИСЬМЕННО)
Установите соответствие между солью и классом (группой) солей, к которому

она принадлежит.
А) Сa(OCl)Cl 1) основные
Б) NaH2PO4 2) кислые
В) Al(OH)SO4 3) средние
Г) Fe(SCN)2 4) двойные
5) смешанные
Слайд 8ЗАДАНИЕ 4 (ПИСЬМЕННО)
Формулы только основных солей указаны в ряду,
KHCO3, Na2Cr2O7, (CUOH)2SO4
CuCl2,

NaHSO3, (AlOH)Cl2
Ca(HCO3)2, ZnS, (FeOH)Cl
(FeOH)NO3, (CuOH)2CO3, MgOHCl
Слайд 9СПОСОБЫ ПОЛУЧЕНИЯ СРЕДНИХ СОЛЕЙ
Основания + кислота:
3NaOH + H3PO4 = Na3PO4 + 3H2O
Основный

оксид + кислота:
MgO + H2SO4 = MgSO4 + H2O
Кислотный оксид + щелочь:
SO3 + 2NaOH = Na2SO4 + H2O
Кислотный оксид + основный оксид:
SO3 + Na2O = Na2SO4
Слайд 10СПОСОБЫ ПОЛУЧЕНИЯ СРЕДНИХ СОЛЕЙ
Соль + кислота:
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
Раствор

соли + раствор соли:
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
Раствор соли + раствор щелочи:
MgSO4 + 2NaOH = Mg(OH)2 + Na2SO4
Слайд 11СПОСОБЫ ПОЛУЧЕНИЯ СРЕДНИХ СОЛЕЙ
Металл + неметалл:
Mg + S = MgS
Металл + раствор

соли:
Mg + CuSO4 = MgSO4 + Cu
Металл + кислота:
Mg + H2SO4 = MgSO4 + H2
Слайд 12ЗАДАНИЕ 5 (ПИСЬМЕННО)
Нерастворимая соль образуется при взаимодействии
KOH(р-р) и H3PO4(р-р)
HCl(р-р) и Mg(NO3)2(р-р)

HNO3(р-р) и CuO
Ca(OH)2(р-р) и CO2
Слайд 13РАЗЛОЖЕНИЕ СРЕДНИХ СОЛЕЙ
Разложение карбонатов 2 группы главной подгруппы:
CaCO3 = CaO + CO2
Разложение

нитратов:
2NaNO3 = 2NaNO2 +O2
2Cu(NO3)2 = 2CuO + 4NO2 +O2
2AgNO3 = 2Ag + 2NO2 + O2
Разложение других солей:
2KMnO4 = K2MnO4 + MnO2 + O2
2KClO3 = 2KCl + 3O2
Слайд 14ПОЛУЧЕНИЕ КИСЛЫХ СОЛЕЙ
Взаимодействие избытка кислоты с основанием:
H3PO4 + NaOH = NaH2PO4 +

H2O
Взаимодействие избытка кислотного оксида с основанием:
CO2 + KOH = KHCO3
Слайд 15ЗАДАНИЕ 6 (ПИСЬМЕННО)
Установите соответствие между реагирующими веществами и продуктами из взаимодействия.
А) KOH

+ SO3(изб) → 1) KHSO4
Б) KOH + SO3(нед) → 2) K2SO3
В) KOH + CO2(изб) → 3) K2CO3 и H2O
Г) KOH + CO2(нед) → 4) K2SO4 и H2O
5) KHCO3
6) KHSO3
Слайд 16ПОЛУЧЕНИЕ ОСНОВНЫХ СОЛЕЙ
Взаимодействие кислоты с избытком основания:
Fe(OH)3 + HCl = Fe(OH)2Cl +

H2O
Взаимодействие избытка соли со щелочью:
Cu(NO3)2 +NaOH = CuOHNO3 + NaNO3
Слайд 17ПЕРЕХОД ОДНИХ СОЛЕЙ В ДРУГИЕ
Средние → кислые:
Na3PO4 + 2H3PO4 =
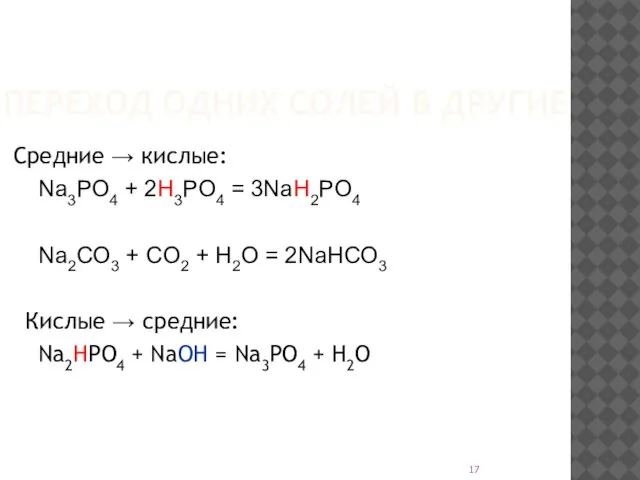
3NaH2PO4
Na2CO3 + CO2 + H2O = 2NaHCO3
Кислые → средние:
Na2HPO4 + NaOH = Na3PO4 + H2O
















 електроліти та неелектроліти
електроліти та неелектроліти Фундаментальные механизмы биохимической адаптации
Фундаментальные механизмы биохимической адаптации Физические и химические свойства алкенов
Физические и химические свойства алкенов Классификация неорганических веществ. Оксиды
Классификация неорганических веществ. Оксиды Сложные вещества кислоты
Сложные вещества кислоты ЦОКО 2 курс. Химия
ЦОКО 2 курс. Химия Дисахариды и полисахариды
Дисахариды и полисахариды Бутилацетат. Химическая формула бутилацетата
Бутилацетат. Химическая формула бутилацетата Водород
Водород Mechanika płynów
Mechanika płynów Основные понятия химии
Основные понятия химии Презентация на тему Галогены и здоровье человека
Презентация на тему Галогены и здоровье человека  Сложные эфиры. Содержание. Определение
Сложные эфиры. Содержание. Определение Алкены. Тестирование
Алкены. Тестирование Соли азотной кислоты
Соли азотной кислоты Ювелирные камни
Ювелирные камни Готовимся к ЕГЭ по органической химии Ароматические углеводороды
Готовимся к ЕГЭ по органической химии Ароматические углеводороды Презентация на тему Аминокислоты
Презентация на тему Аминокислоты  Поверхность потенциальной энергии и расчет сил, действующих на ионы
Поверхность потенциальной энергии и расчет сил, действующих на ионы Металлы. Определения
Металлы. Определения Презентация на тему Катализ
Презентация на тему Катализ  Задача №3: Трансмутация. Команда: Карбораны
Задача №3: Трансмутация. Команда: Карбораны Презентация на тему Моющие и чистящие средства
Презентация на тему Моющие и чистящие средства  Окислительно – восстановительные реакции (урок химии в 11 классе)
Окислительно – восстановительные реакции (урок химии в 11 классе) AB-Polymerchemie Referenze
AB-Polymerchemie Referenze Гетерогенные химические системы и поверхностные явления в них
Гетерогенные химические системы и поверхностные явления в них Примеры карбоновых кислот
Примеры карбоновых кислот Биологически важные реакции монофункциональных соединений. Реакционная способность альдегидов, кетонов, карбоновых кислот
Биологически важные реакции монофункциональных соединений. Реакционная способность альдегидов, кетонов, карбоновых кислот