Содержание
- 2. В ходе урока учащиеся должны: — проводить стехиометрические расчеты по уравнению реакции; — вычислять количество или
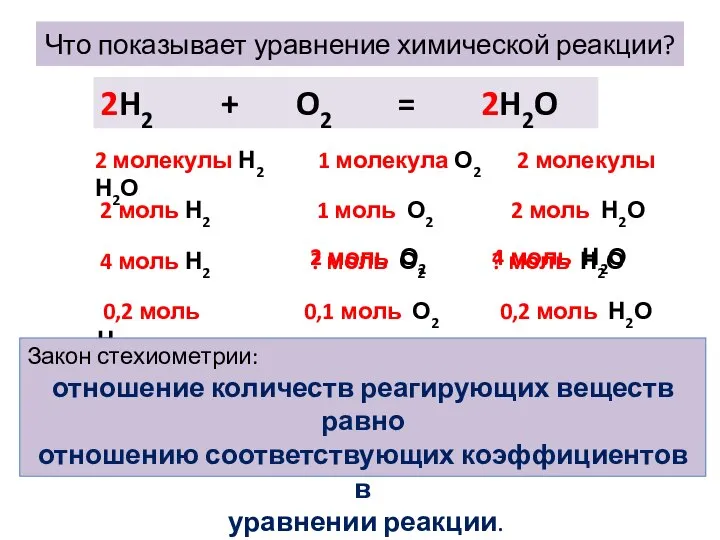
- 3. Что показывает уравнение химической реакции? 2H2 + O2 = 2H2O 2 молекулы Н2 1 молекула О2
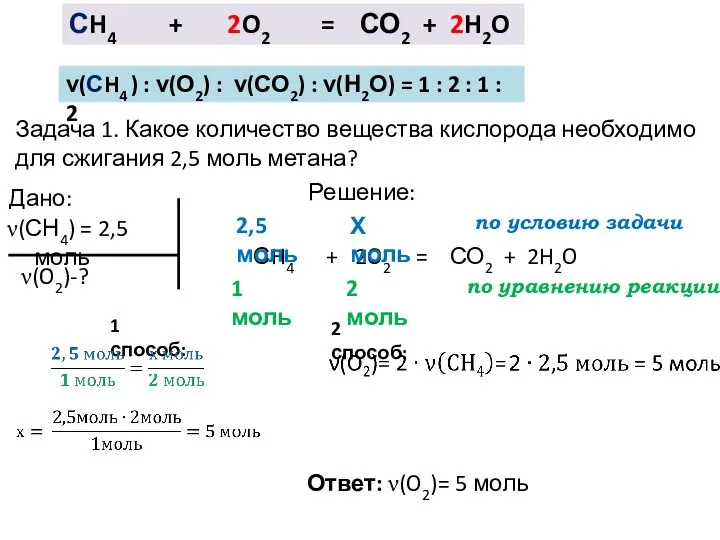
- 4. СH4 + 2O2 = СО2 + 2H2O ν(СH4 ) : ν(О2) : ν(СО2) : ν(Н2О) =
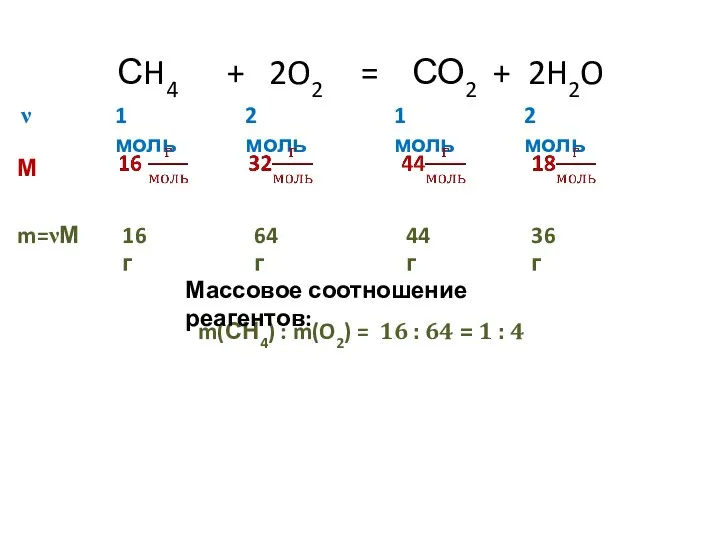
- 5. СH4 + 2O2 = СО2 + 2H2O 1 моль 2 моль 1 моль 2 моль ν
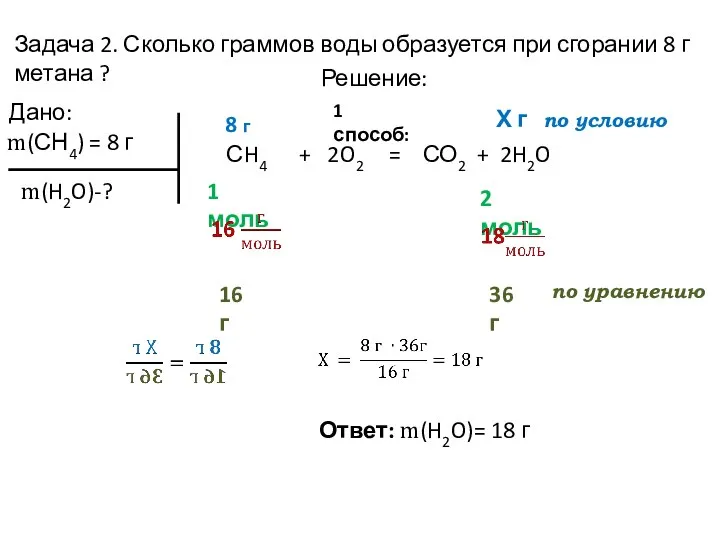
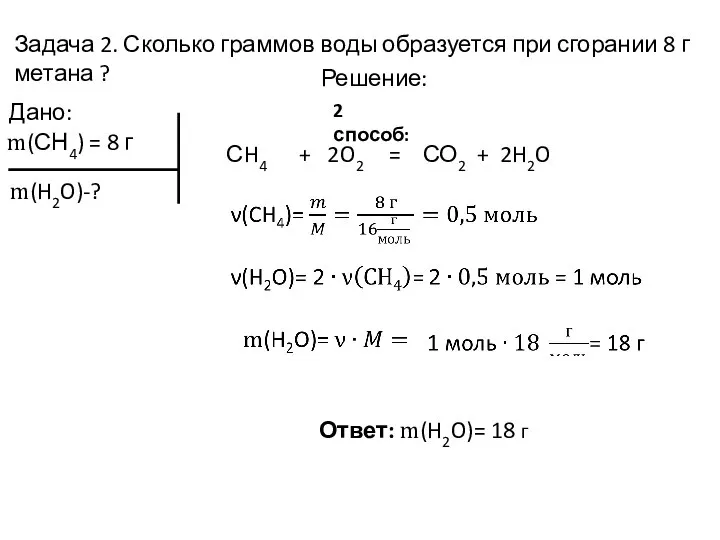
- 6. Задача 2. Сколько граммов воды образуется при сгорании 8 г метана ? Дано: m(СН4) = 8
- 7. Задача 2. Сколько граммов воды образуется при сгорании 8 г метана ? Дано: m(СН4) = 8
- 8. Какая масса оксида железа (II, III) образуется при сгорании в кислороде 5,6 г железа? 1) записать
- 10. Скачать презентацию


 Карбоновые кислоты. Тест. 10 класс
Карбоновые кислоты. Тест. 10 класс Презентация на тему Неметаллы
Презентация на тему Неметаллы  Азотная кислота
Азотная кислота Расчет энергетического профиля реакции N,N,N’,N’-тетраметилгуанидина с о-метиленхиноном
Расчет энергетического профиля реакции N,N,N’,N’-тетраметилгуанидина с о-метиленхиноном Железо и его соединения
Железо и его соединения Изменения, происходящие с веществами. Физические явления в химии
Изменения, происходящие с веществами. Физические явления в химии Презентация на тему Общая характеристика галогенов
Презентация на тему Общая характеристика галогенов  Азотная кислота
Азотная кислота Структура к свойства веществ
Структура к свойства веществ Проектная работа по химии «Жидкий азот» Выполнили учащиеся 10Б класса Лобакин А. и Тумаков И.
Проектная работа по химии «Жидкий азот» Выполнили учащиеся 10Б класса Лобакин А. и Тумаков И. Периодический закон и строение атома
Периодический закон и строение атома Химия неорганическая и органическая
Химия неорганическая и органическая Лаборатория гидрометаллургических процессов
Лаборатория гидрометаллургических процессов Окислительно- восстановительные реакции
Окислительно- восстановительные реакции Химическая кинетика
Химическая кинетика Квантовая химия
Квантовая химия Х 9 Урок 7 Электролитическая диссоциация
Х 9 Урок 7 Электролитическая диссоциация Peek. Сферы применения
Peek. Сферы применения Век медный, бронзовый, железный
Век медный, бронзовый, железный Электролитическая диссоциация. Устойчивость комплексных соединений
Электролитическая диссоциация. Устойчивость комплексных соединений Молекулярная струйная печать
Молекулярная струйная печать строение атома
строение атома Сухой лёд
Сухой лёд Кислородосодержащие органические соединения. Cпирты (алканолы)
Кислородосодержащие органические соединения. Cпирты (алканолы) Периодический закон и периодическая система химических элементов. 11 класс
Периодический закон и периодическая система химических элементов. 11 класс Электрохимическая коррозия
Электрохимическая коррозия Презентация на тему Свойства черных и цветных металлов
Презентация на тему Свойства черных и цветных металлов  Курсовой синтез ацетоуксусного эфира
Курсовой синтез ацетоуксусного эфира