Содержание
- 2. Вспомни… Какие соединения называют оксидами? СаО, SО2, ВаО , Nа2О, Сl2О7, Al2O3 Какие соединения относят к
- 3. Работа с карточками Из предложенного списка веществ выпишите оксиды и щёлочи: CaO, CI2O7, NaOH, HCI, CO2,
- 4. Правильные ответы: Оксиды: CaO, CI2O7, CO2 , AL2O3, K2O, N2O5, SO3 Щёлочи: NaOH, LiOH, КОН
- 5. Тема урока: «КИСЛОТЫ» Цель урока: изучение строения, классификации и свойств неорганических кислот
- 6. Задачи урока: изучить строение и свойства кислот; познакомиться с классификацией кислот; узнать формулы некоторых неорганических кислот;
- 7. Кислоты в природе Муравьиная кислота Лимонная кислота Аскорбиновая кислота
- 8. Кислоты в жизни человека В медицине В кулинарии и продуктах питания В народном хозяйстве В организме
- 9. Кислотные дожди – одна из экологических проблем Н2О Н2О Н2О NО2 SО2 Н2S Н2SО3 НNО3 НNО2
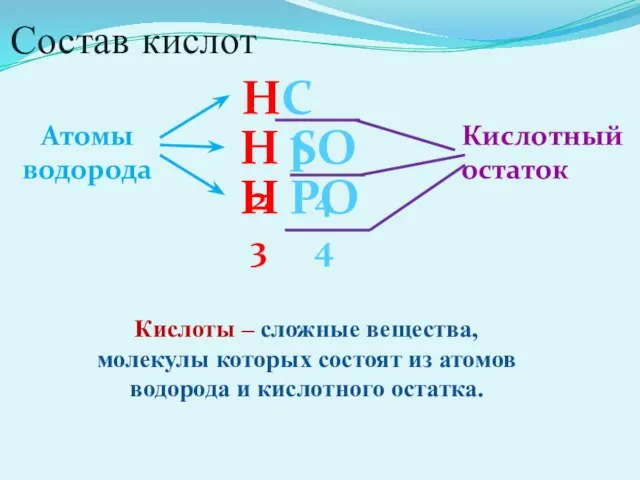
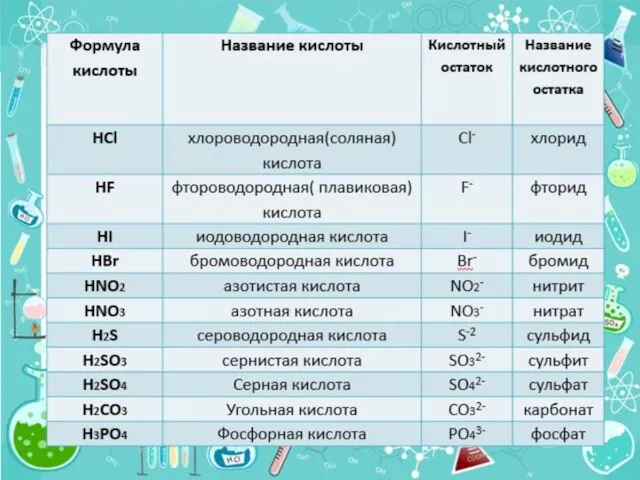
- 10. Состав кислот Н Сl Н2 SО4 Н3 РО4 Атомы водорода Кислотный остаток Кислоты – сложные вещества,
- 11. Независимо от вида кислоты, индикаторы изменяют свой цвет одинаково, а это означает, что все кислоты обладают
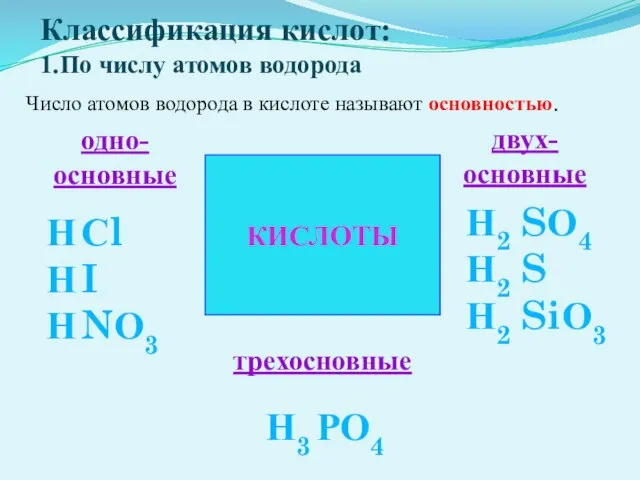
- 13. Классификация кислот: 1.По числу атомов водорода КИСЛОТЫ Сl I NО3 SО4 S SiО3 РО4 одно- основные
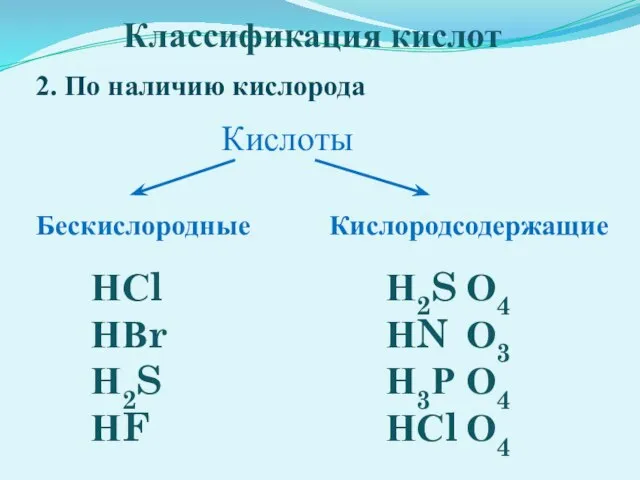
- 14. Кислоты Бескислородные Кислородсодержащие НСl НВr Н2S НF Н2S НN Н3Р НСl Классификация кислот 2. По наличию
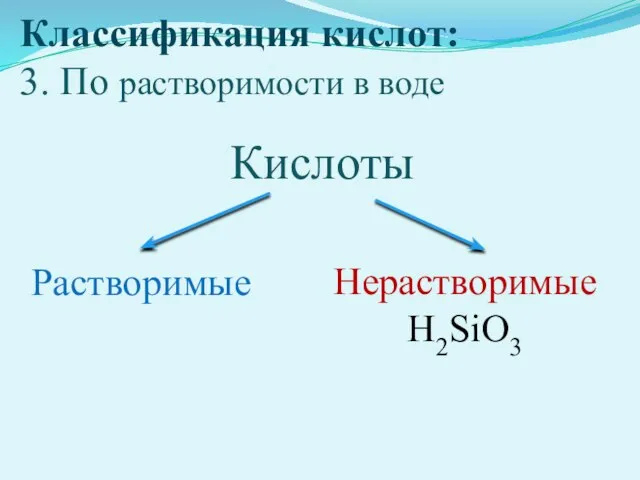
- 15. Классификация кислот: 3. По растворимости в воде Кислоты Растворимые Нерастворимые H2SiO3
- 16. Серная кислота - H2SO4
- 17. Физкультминутка Очень химию мы любим! Шеей влево, вправо крутим. Воздух – это атмосфера. Если правда -
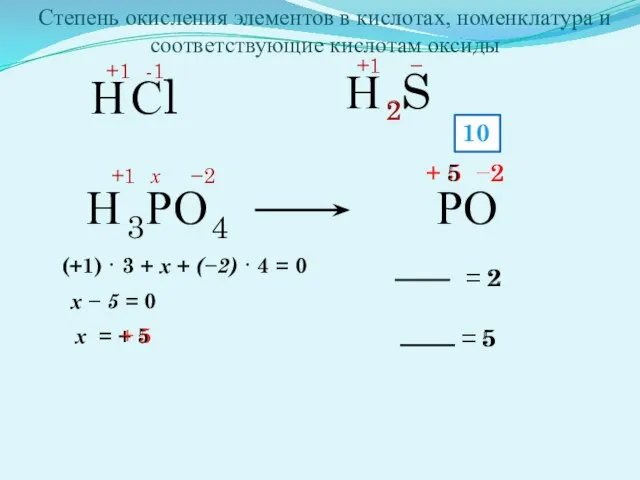
- 18. Степень окисления – это условный заряд атомов химического элемента в соединении, вычисленный из предположения, что все
- 19. Н Сl +1 -1 Н +1 − 2 S 2 Н 3 РО 4 +1 −2
- 20. Дайте характеристику кислотам по алгоритму: Название кислоты Наличие кислорода Основность Растворимость Степень окисления элементов, образующих кислоту
- 21. Кислотные оксиды CI2 O7 → CO2 → N2 O5 → S O3 →
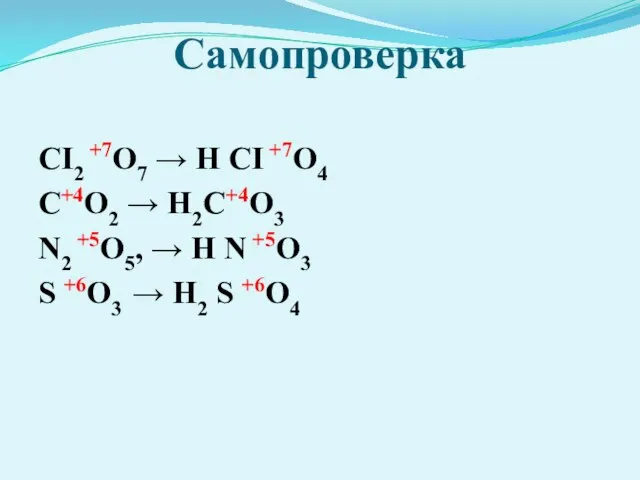
- 22. Самопроверка CI2 +7O7 → Н CI +7O4 C+4O2 → Н2С+4О3 N2 +5O5, → Н N +5O3
- 23. Домашнее задание: Выучить формулы и названия кислот § 21; Дать характеристику кремниевой кислоте по алгоритму ;
- 25. «День прожит не зря, если ты узнал что-то новое»
- 26. Спасибо за урок !
- 28. Скачать презентацию

















 Алкены. Строение
Алкены. Строение Строение атома
Строение атома Теоретические основы органической химии. Строение атома углерода. Гибридизация. Номенклатура и изомерия
Теоретические основы органической химии. Строение атома углерода. Гибридизация. Номенклатура и изомерия Алкены (этиленовые углеводороды)
Алкены (этиленовые углеводороды) Элементы и атомы, В менделеевский взяты круг Сделали химию самой богатой И самой творческой из наук.
Элементы и атомы, В менделеевский взяты круг Сделали химию самой богатой И самой творческой из наук. Основные физические и химические величины. Элективный курс в 10 классе Решение задач по химии
Основные физические и химические величины. Элективный курс в 10 классе Решение задач по химии Применение алкенов
Применение алкенов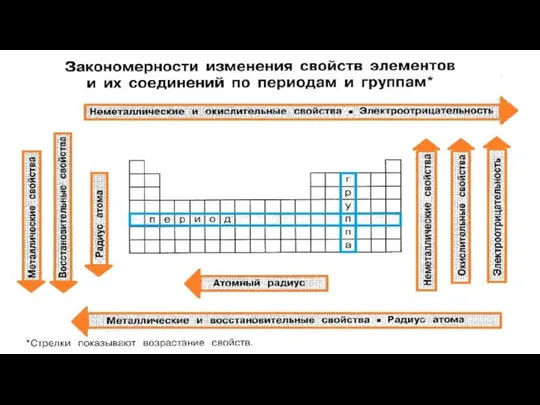 Закономерности изменения свойств элементов и их соединений по периодам и группам
Закономерности изменения свойств элементов и их соединений по периодам и группам Химическая технология. Структура ВКР
Химическая технология. Структура ВКР ТБ_1 (1)
ТБ_1 (1) Алканы. Этан
Алканы. Этан Простые вещества - металлы. 8 класс
Простые вещества - металлы. 8 класс Селективность (реакторы)
Селективность (реакторы) Презентация по Химии "Исследование влияния токсикантов на активность ферментов на примере уреазы"
Презентация по Химии "Исследование влияния токсикантов на активность ферментов на примере уреазы"  Массовые доли веществ задачи
Массовые доли веществ задачи Агрегатные состояния вещества
Агрегатные состояния вещества Основания. Равновесия в растворах
Основания. Равновесия в растворах Химические свойства основных оксидов. 9 класс
Химические свойства основных оксидов. 9 класс Спирты. Классификация
Спирты. Классификация Микроструктура железоуглеродистых сплавов в равновесном состоянии
Микроструктура железоуглеродистых сплавов в равновесном состоянии Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Теория химического строения органических веществ А.М. Бутлерова
Теория химического строения органических веществ А.М. Бутлерова Производство метанола
Производство метанола Презентация на тему Серная кислота
Презентация на тему Серная кислота  Вирощування кристалів солей
Вирощування кристалів солей Химический состав водотоков архипилага Новая земля и их воздействие на прибрежную зону
Химический состав водотоков архипилага Новая земля и их воздействие на прибрежную зону Металлы. Группы металлов
Металлы. Группы металлов Оксиды неметаллов и металлов. Состав и названия
Оксиды неметаллов и металлов. Состав и названия