Содержание
- 2. Положение серы в ПСХЭ
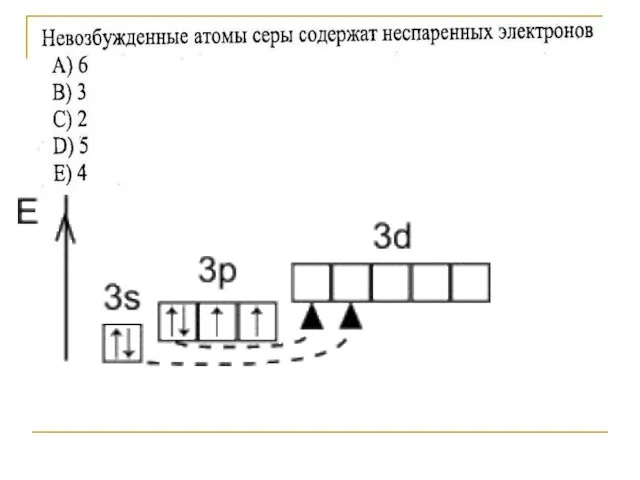
- 3. Строение атома серы
- 4. Окислительно-восстановительные свойства S-2 ⇄ S0 ⇄ S+4 ⇄ S+6 S-2 → только восстановители S0 → окислители,
- 5. *В свободном виде (самородная сера). *В виде соединений: органических и неорганических (сульфиды и сульфаты). *В составе
- 6. Самородная сера, серный колчедан FeS2, медный колчедан CuFeS2, свинцовый блеск PbS с цинковой обманкой ZnS (Балхаш
- 7. Физические свойства серы Агрегатное состояние ТВЕРДОЕ КРИСТАЛЛИЧЕСКОЕ Цвет ЖЕЛТЫЙ Запах БЕЗ ЗАПАХА Растворимость в воде НЕ
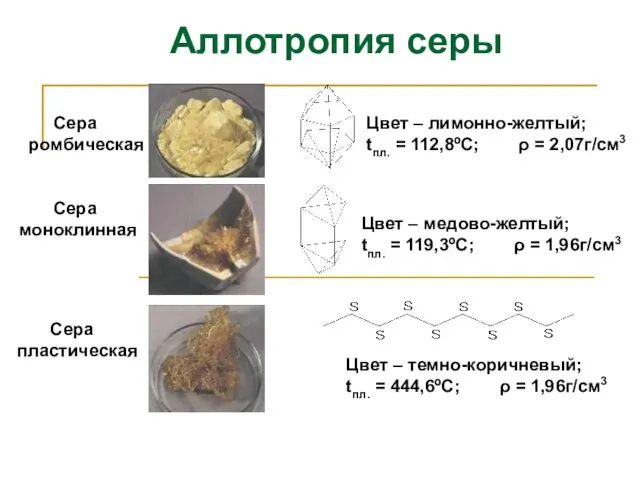
- 8. Сера ромбическая Сера пластическая Сера моноклинная Цвет – лимонно-желтый; tпл. = 112,8ºС; ρ = 2,07г/см3 Цвет
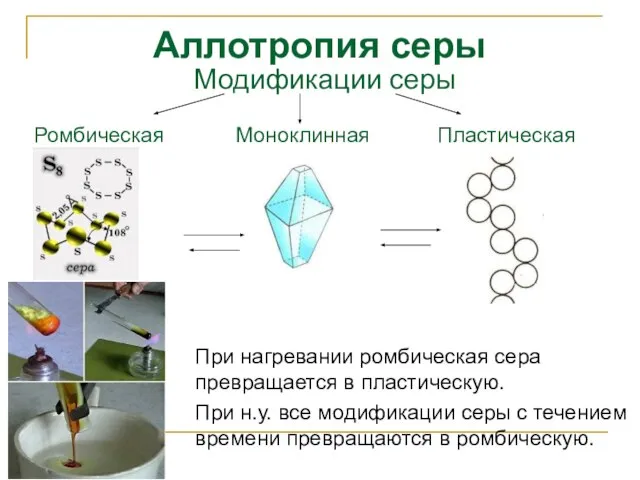
- 9. Аллотропия серы При нагревании ромбическая сера превращается в пластическую. При н.у. все модификации серы с течением
- 10. Проявляет окислительные свойства (степень окисления -2) а) с металлами: 2Na + S = Na2S – сульфид
- 11. 2. Проявляет восстановительные свойства (степень окисления +4, +6) а) с кислородом (+4): S + O2 =
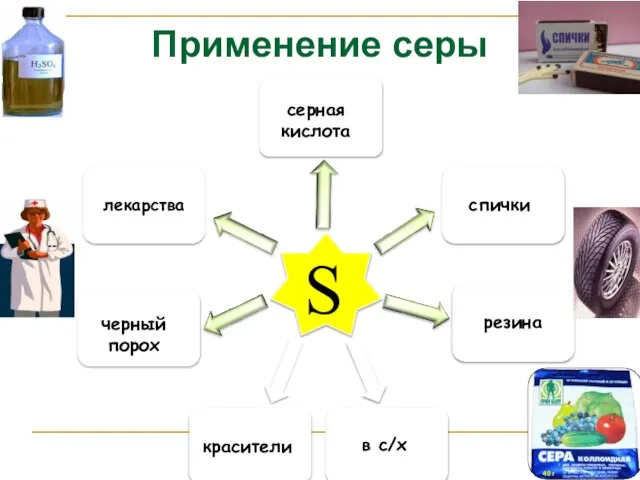
- 12. Применение серы
- 17. Скачать презентацию










 Презентация на тему Электрохимический ряд напряжений металлов
Презентация на тему Электрохимический ряд напряжений металлов  Дисперсные системы с твёрдой средой и газообразной фазой
Дисперсные системы с твёрдой средой и газообразной фазой _Периодический закон. Распределение электронов по энергетическим уровням и подуровням (1)
_Периодический закон. Распределение электронов по энергетическим уровням и подуровням (1) Молярный объем
Молярный объем Щелочные металлы — это элементы главной подгруппы I группы
Щелочные металлы — это элементы главной подгруппы I группы Металлом называется светлое тело, которое ковать можно
Металлом называется светлое тело, которое ковать можно Презентация на тему Нанохимия
Презентация на тему Нанохимия  Элементы и атомы, В менделеевский взяты круг Сделали химию самой богатой И самой творческой из наук.
Элементы и атомы, В менделеевский взяты круг Сделали химию самой богатой И самой творческой из наук. Современная аналитическая химия.Учебная литература
Современная аналитическая химия.Учебная литература Урок № 4
Урок № 4 Фторопласты и их использование
Фторопласты и их использование Свойства солей, оксидов, оснований
Свойства солей, оксидов, оснований Криогенный разрыв пласта
Криогенный разрыв пласта Астат. Свойства астата
Астат. Свойства астата Презентация на тему Сведения о воде
Презентация на тему Сведения о воде  Стероиды. Дицетин-холестерин-ацилтрансферазная реакция
Стероиды. Дицетин-холестерин-ацилтрансферазная реакция Направление процесса. ОВР
Направление процесса. ОВР Гликолиз. Глюконеогенез. Пентозофосфатный путь
Гликолиз. Глюконеогенез. Пентозофосфатный путь Применение центрифугирования
Применение центрифугирования Основания. 8 класс
Основания. 8 класс Презентация по Химии "Строение и физические свойства металлов"
Презентация по Химии "Строение и физические свойства металлов"  Химические свойства металлов. Электрохимический ряд напряжения металлов
Химические свойства металлов. Электрохимический ряд напряжения металлов Звездный час. Конкурс химиков
Звездный час. Конкурс химиков Bool-doser team
Bool-doser team Вещество. Свойства вещества. Урок №2
Вещество. Свойства вещества. Урок №2 Титриметрический анализ
Титриметрический анализ Проточные реакторы непрерывного действия. (Лекция 5)
Проточные реакторы непрерывного действия. (Лекция 5) Химический анализ
Химический анализ