Содержание
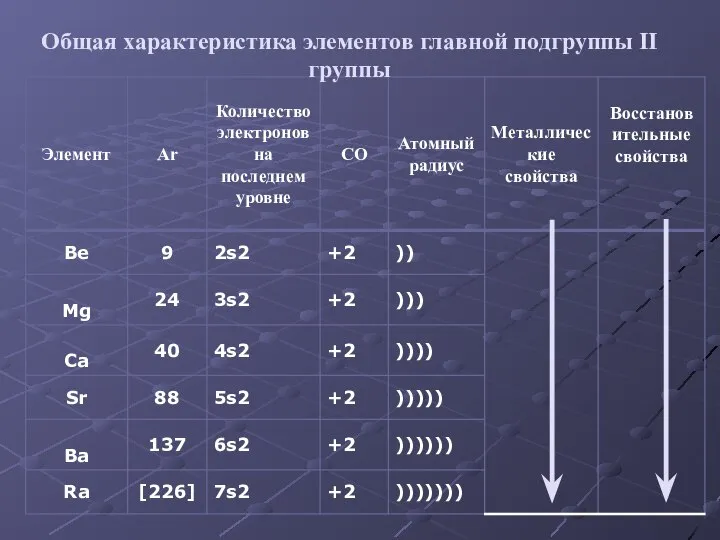
- 2. Общая характеристика элементов главной подгруппы II группы
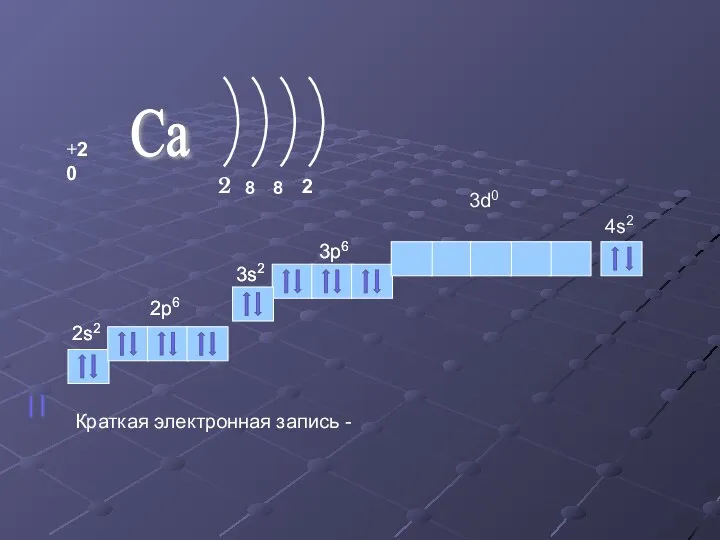
- 3. Краткая электронная запись - 2s2 2s2 2p6 2p6 3s2 3s2 3p6 3p6 4s2 3d0
- 4. Ве - амфотерный металл, Mg – металл, Сa, Sr,Ba - щёлочноземельные металлы Ra –радиоактивный элемент
- 5. Общая характеристика элементов главной подгруппы II группы Одинаковое строение внешнего электронного слоя Элементы проявляют С.О. +2
- 6. Be – светло-серый, твердый, хрупкий Ca – твердый, пластичный Mg – относительно мягкий, пластичный, ковкий Sr
- 7. 2Me0 +O2 → 2Me+2O-2 Me0 +H2 → Me+2H2 Me0 +Cl02 → Me+2Cl2 Me0 +S0 → Me+2S-2
- 8. Сравните атомы элементов, поставив знаки или = вместо *: а) заряд ядра: Mg * Ca, Na
- 10. Скачать презентацию





 Упражнения. Масс-спектрометрия
Упражнения. Масс-спектрометрия Строение вещества. Виды химической связи
Строение вещества. Виды химической связи Турнир знатоков химии
Турнир знатоков химии Химические формулы
Химические формулы Хром
Хром Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок
Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок Способы выражения концентраций растворов
Способы выражения концентраций растворов Интерактивная интеллектуальная игра. Юный химик
Интерактивная интеллектуальная игра. Юный химик Определение степеней окисления и расстановка коэффициентов в ОВР
Определение степеней окисления и расстановка коэффициентов в ОВР Презентация на тему Природный и попутный нефтяной газы, их состав, использование
Презентация на тему Природный и попутный нефтяной газы, их состав, использование  Синтез.Малахит
Синтез.Малахит Гидролиз солей
Гидролиз солей Степень окисления. Составление формул бинарных соединений
Степень окисления. Составление формул бинарных соединений Презентация на тему Виды химической связи
Презентация на тему Виды химической связи  Fyzikálne a chemické deje
Fyzikálne a chemické deje Ліпіди
Ліпіди Непредельные углеводороды
Непредельные углеводороды Йод. Свойства
Йод. Свойства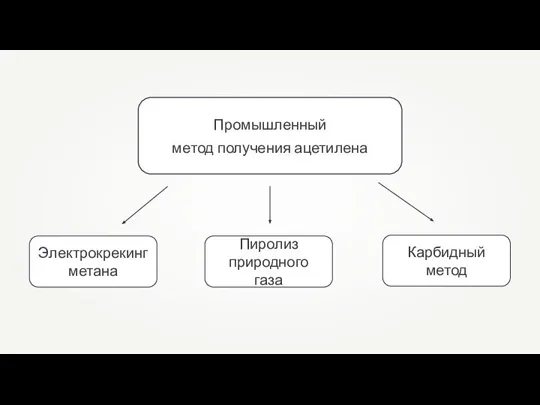 Промышленный метод получения ацетилена
Промышленный метод получения ацетилена Средства ухода за кожей
Средства ухода за кожей Исследовательская работа по химии на тему: Интегративные проблемные ситуации
Исследовательская работа по химии на тему: Интегративные проблемные ситуации Презентация на тему Валентность и степень окисления (8 класс)
Презентация на тему Валентность и степень окисления (8 класс)  Использование информационных технологий в образовательном процессе на примере химии
Использование информационных технологий в образовательном процессе на примере химии Ароматические и гетероциклические соединения. Электронная спектроскопия
Ароматические и гетероциклические соединения. Электронная спектроскопия Методы очистки воды от тяжелых металлов Выполнила: студентка 4 курса 41 группы естественно-географического факультета Кузнецова
Методы очистки воды от тяжелых металлов Выполнила: студентка 4 курса 41 группы естественно-географического факультета Кузнецова Основания. Номенклатура
Основания. Номенклатура Скорость химической реакции и химическое равновесие. Задание 20 в ЕГЭ
Скорость химической реакции и химическое равновесие. Задание 20 в ЕГЭ Природный и попутный газы, их состав и использование
Природный и попутный газы, их состав и использование