Содержание
- 2. Классификация химических реакций по признаку выделения или поглощения теплоты В процессе химической реакции происходит перегруппировка атомов
- 3. Экзотермические реакции Реакции, которые протекают с выделением теплоты, называют экзотермическими. В переводе с греческого приставка экзо-
- 4. Эндотермические реакции Реакции, которые протекают с поглощением теплоты, называют эндотермическими. В переводе с греческого приставка эндо-
- 6. Скачать презентацию



 Природные источники углеводородов
Природные источники углеводородов Алканы и их свойства
Алканы и их свойства Разбор задач
Разбор задач Амфотерные соединения
Амфотерные соединения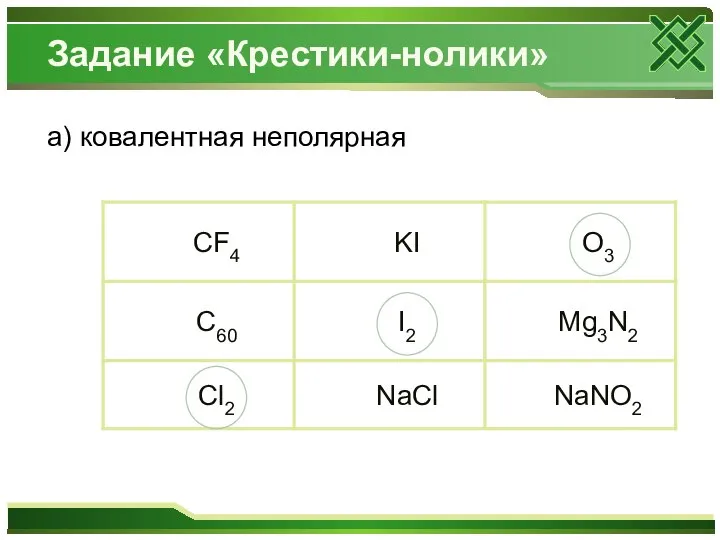 Степень окисления. 8 класс
Степень окисления. 8 класс Круговорот серы в природе
Круговорот серы в природе Структура и свойства латуни. Изучение структуры латунного спая лемеха
Структура и свойства латуни. Изучение структуры латунного спая лемеха Химический анализ растворов этилового спирта черной смородины
Химический анализ растворов этилового спирта черной смородины Исследование снега на общую химическую токсичность методом биотестирования Автор: Милюта Юлия, Тюменская область, Тюменский рай
Исследование снега на общую химическую токсичность методом биотестирования Автор: Милюта Юлия, Тюменская область, Тюменский рай Сравнительная характеристика стиральных порошков
Сравнительная характеристика стиральных порошков Презентация на тему Кальций
Презентация на тему Кальций  Подготовка к ГИА по химии
Подготовка к ГИА по химии Основания. 8 класс
Основания. 8 класс Презентация на тему: Чистые вещества и смеси
Презентация на тему: Чистые вещества и смеси Водные биоресурсы и аквакультура. Расчеты в объемном анализе
Водные биоресурсы и аквакультура. Расчеты в объемном анализе Кумарон - индендық полимерлер
Кумарон - индендық полимерлер Сплавы металлов
Сплавы металлов Concise asymmetric total synthesis of lycopodine
Concise asymmetric total synthesis of lycopodine Виды изомерии. Углеводороды
Виды изомерии. Углеводороды Осуществление цепочки химических превращений. Практическая работа №1
Осуществление цепочки химических превращений. Практическая работа №1 Биосенсоры. Основные принципы (лекция 2)
Биосенсоры. Основные принципы (лекция 2) Плотность вещества
Плотность вещества Химическая связь
Химическая связь Производство полимеров в РК
Производство полимеров в РК Ювелирные камни
Ювелирные камни Металлы побочных подгрупп
Металлы побочных подгрупп Карбоновые кислоты и их гетерофункциональные производные: гидрокси- и оксокарбоновые кислоты
Карбоновые кислоты и их гетерофункциональные производные: гидрокси- и оксокарбоновые кислоты Периодический закон Д. Менделеева с точки зрения строения атома. Часть 1
Периодический закон Д. Менделеева с точки зрения строения атома. Часть 1