Содержание
- 2. Лекция № 2 Протолитические буферные системы. Буферные системы организма, их взаимоднйствие
- 3. Содержание лекции Буферные растворы. Определение, состав Типы буферных систем 3. Механизм буферного действия 4. Расчет рН
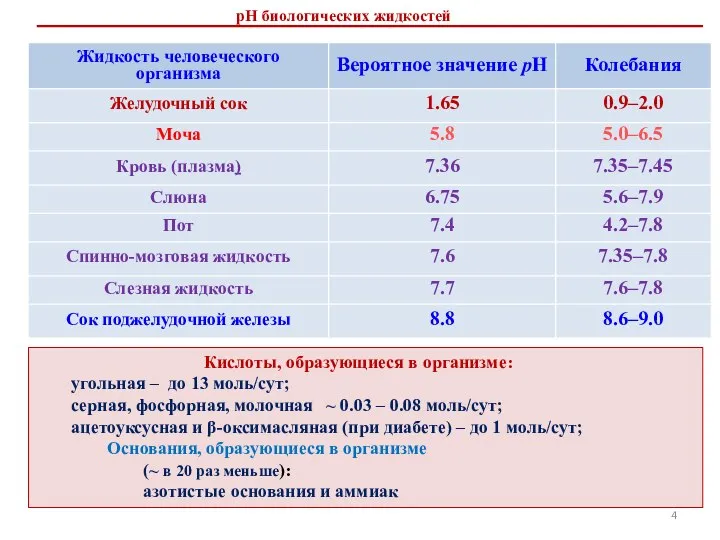
- 4. рН биологических жидкостей Кислоты, образующиеся в организме: угольная – до 13 моль/сут; серная, фосфорная, молочная ~
- 5. Кислотно-основные (протолитические) буферные системы Буферный раствор – раствор, содержащий протолитическую равновесную систему, способную поддерживать практически постоянное
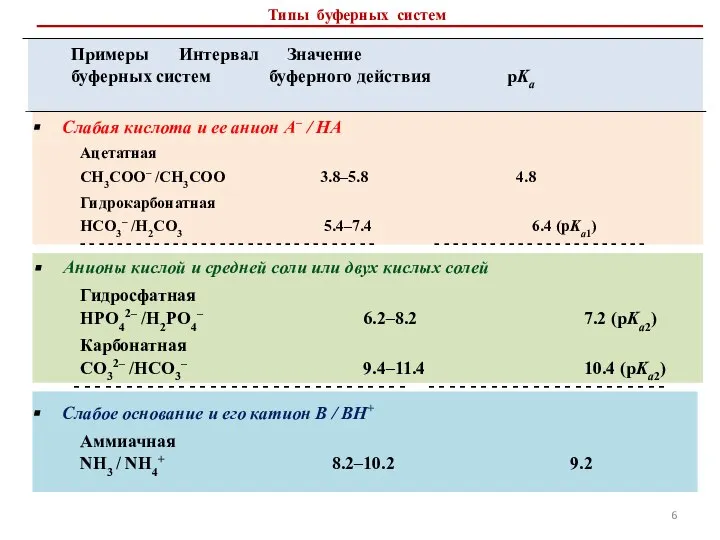
- 6. Типы буферных систем Примеры Интервал Значение буферных систем буферного действия рKа Слабая кислота и ее анион
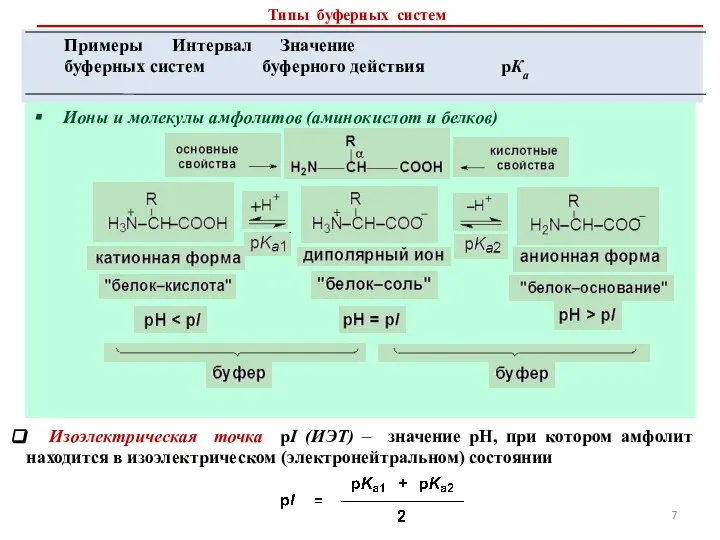
- 7. Ионы и молекулы амфолитов (аминокислот и белков) Изоэлектрическая точка pI (ИЭТ) – значение рН, при котором
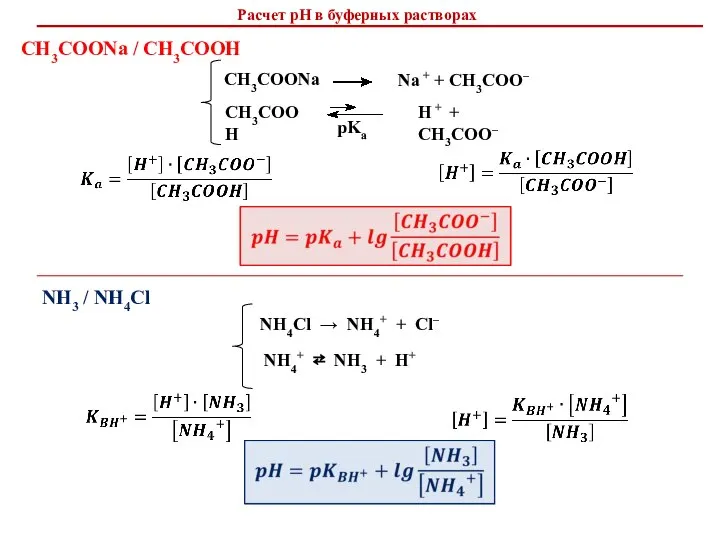
- 8. CH3COOH CH3COONa H + + CH3COO– Na + + CH3COO– Расчет рН в буферных растворах СН3СООNa
- 9. Уравнение Гендерсона-Хассельбаха
- 10. 4. Используя уравнение Гендерсона–Хассельбаха, можно вычислить, в каком соотношении нужно взять компоненты буферного раствора, чтобы приготовить
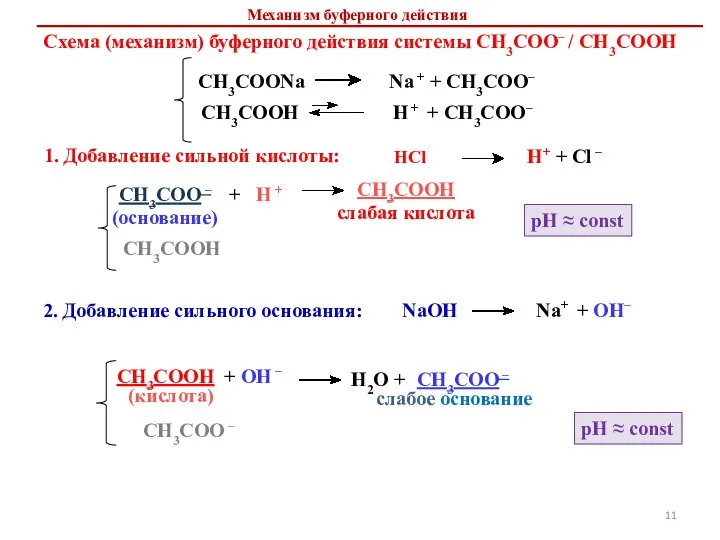
- 11. Схема (механизм) буферного действия системы СН3СОО– / СН3СООН 1. Добавление сильной кислоты: CH3COO – + H
- 12. Буферная емкость Вa(b) — количество кислоты или щелочи, которые нужно добавить к 1 л буферного раствора,
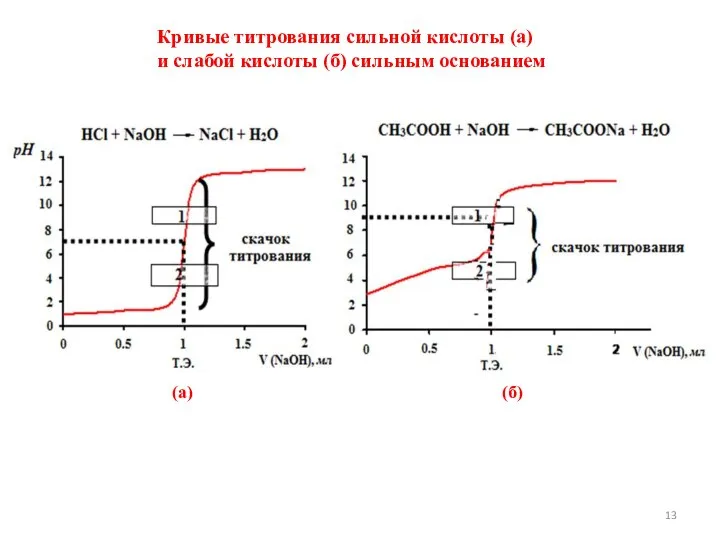
- 13. Кривые титрования сильной кислоты (а) и слабой кислоты (б) сильным основанием (а) (б)
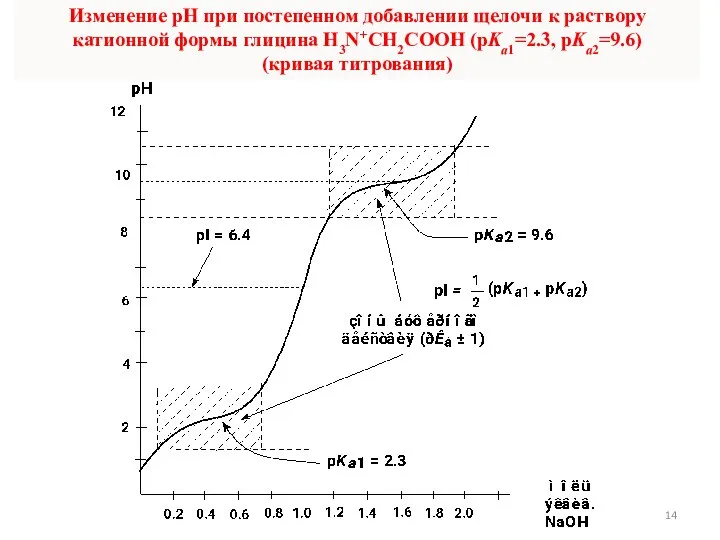
- 14. Изменение рН при постепенном добавлении щелочи к раствору катионной формы глицина H3N+CH2COOH (pKa1=2.3, pKa2=9.6) (кривая титрования)
- 15. Кислотно-основное состояние (КОС) организма человека Плазма крови: рН = 7.40 ± 0.05; a(H+) = 3.7·10–8 –
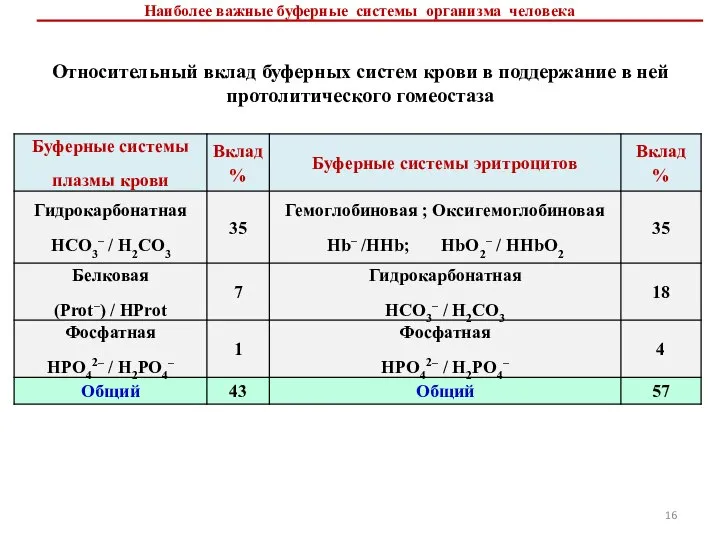
- 16. Наиболее важные буферные системы организма человека Относительный вклад буферных систем крови в поддержание в ней протолитического
- 17. В плазме: [HCO3–]/[CO2 + H2CO3] ≈ 20 : 1 Bк = 40 ммоль/л Bщ = 1–2
- 18. Гидрофосфатная буферная система (в плазме крови – Na2НРО4/NaН2РО4; в клетке – K2НРО4/KН2РО4) В плазме крови: Вк
- 19. Белковые буферные системы крови
- 20. В эритроцитах: при pH = 7.25 Система гемоглобин (Hb– /ННb) – оксигемоглобин (HbO2– /ННbО2) O2 O2
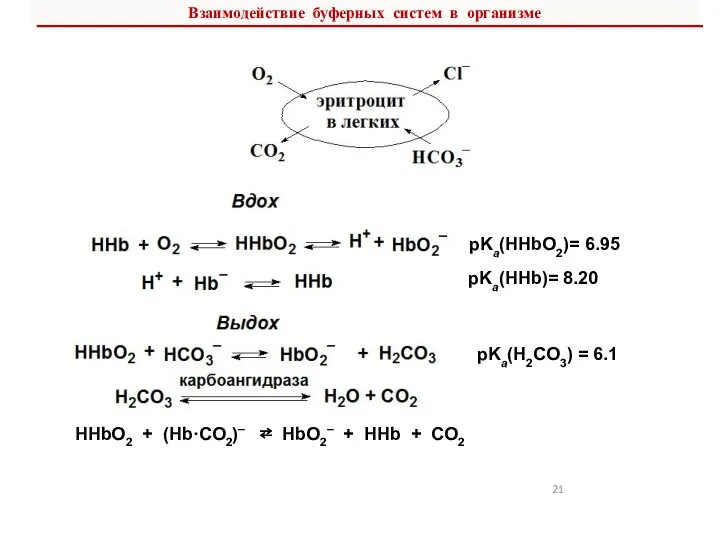
- 21. Взаимодействие буферных систем в организме pKa(HHbO2)= 6.95 pKa(HHb)= 8.20 рKa(H2CO3) = 6.1 HHbO2 + (Hb·CO2)– ⇄
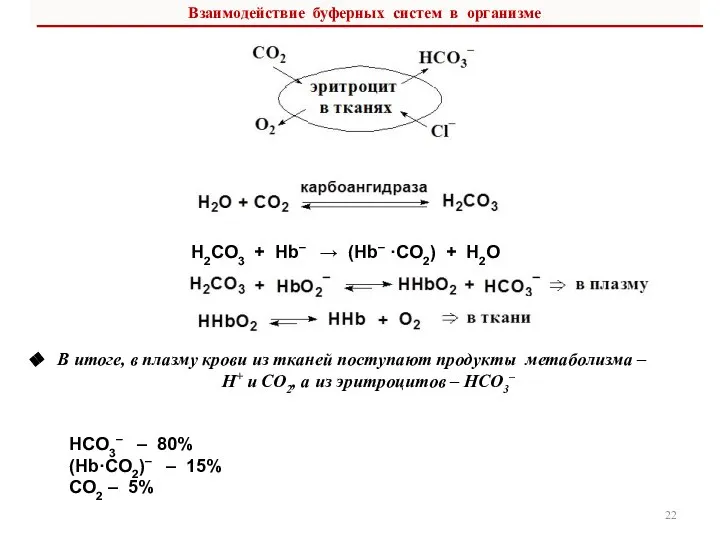
- 22. В итоге, в плазму крови из тканей поступают продукты метаболизма – Н+ и СО2, а из
- 23. Показатели кислотно-основного состояния (КОС) крови (кислотно-щелочного равновесия (КЩР) крови) Показатель КОС Название Значение в норме Изменения
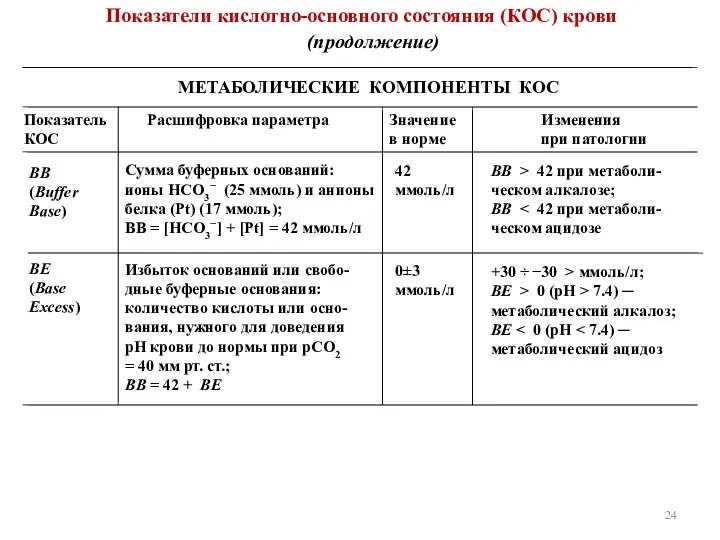
- 24. Показатели кислотно-основного состояния (КОС) крови (продолжение) МЕТАБОЛИЧЕСКИЕ КОМПОНЕНТЫ КОС Показатель КОС Расшифровка параметра Значение в норме
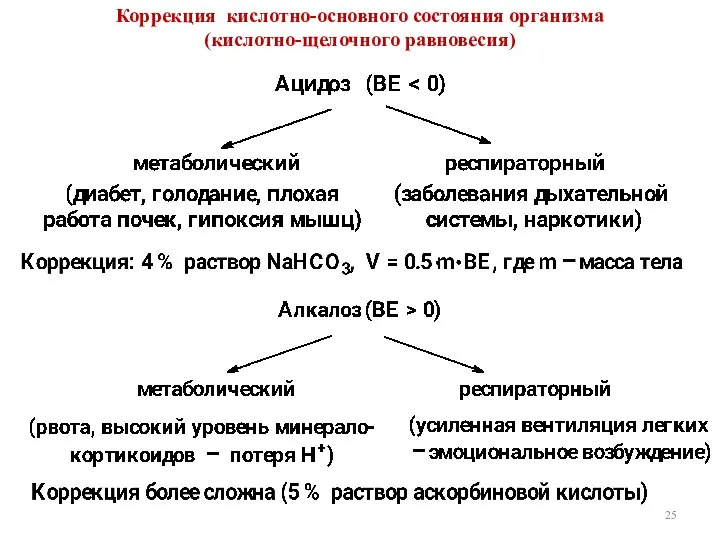
- 25. Коррекция кислотно-основного состояния организма (кислотно-щелочного равновесия)
- 26. Примеры расчетов для буферных растворов
- 27. Примеры расчетов для буферных растворов
- 28. Примеры расчетов для буферных растворов
- 29. Примеры расчетов для буферных растворов
- 31. Скачать презентацию







![В плазме: [HCO3–]/[CO2 + H2CO3] ≈ 20 : 1 Bк = 40](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/927244/slide-16.jpg)








 Презентация на тему Химическая связь и её типы
Презентация на тему Химическая связь и её типы  Различные виды красителей
Различные виды красителей Степень окисления
Степень окисления Алканы. Химические совйства
Алканы. Химические совйства Металлы. Общая характеристика, химические свойства. Получение
Металлы. Общая характеристика, химические свойства. Получение Степени окисления и формулы веществ
Степени окисления и формулы веществ Пластмассы
Пластмассы Металлы и неметаллы. Знакомство с периодической системой Д. И. Менделеева
Металлы и неметаллы. Знакомство с периодической системой Д. И. Менделеева Химические явления. Закон сохранения массы веществ
Химические явления. Закон сохранения массы веществ Расчеты по химическим уравнениям
Расчеты по химическим уравнениям Плотность вещества
Плотность вещества Презентация на тему Нефть и способы ее переработки
Презентация на тему Нефть и способы ее переработки  Направление процесса. ОВР
Направление процесса. ОВР Алмашу реакциясе
Алмашу реакциясе Язык естествознания. Химия
Язык естествознания. Химия Номенклатура и изомерия карбоновых кислот
Номенклатура и изомерия карбоновых кислот Строение электронной оболочки атома часть 2
Строение электронной оболочки атома часть 2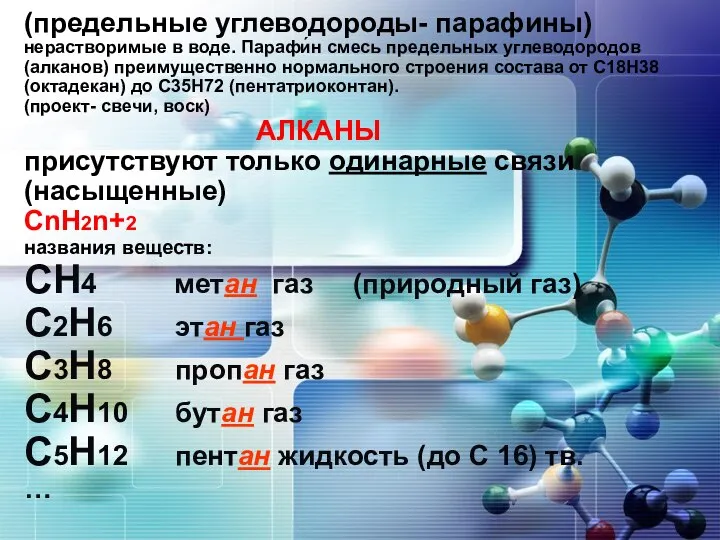 Углеводороды
Углеводороды Презентация на тему Алюминий(Al)
Презентация на тему Алюминий(Al)  Каучуки, их история и виды использования
Каучуки, их история и виды использования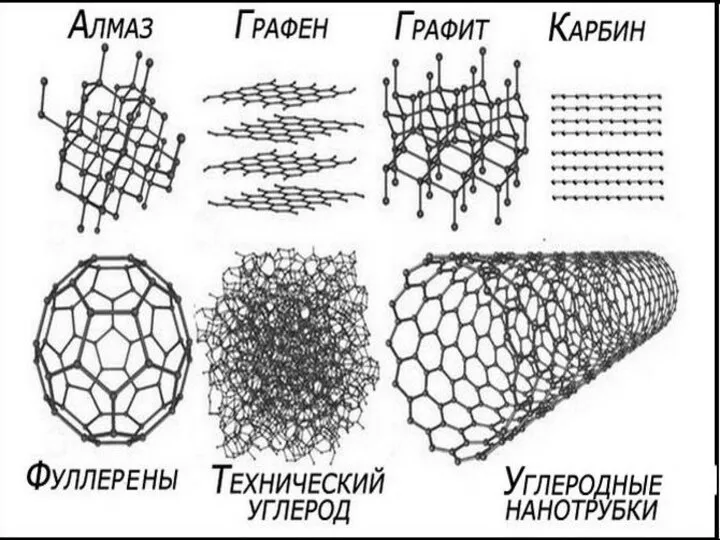 Углеродные нанотрубки
Углеродные нанотрубки Общая и неорганическая химия. Строение атома и периодическая система. Химическая связь и строение вещества
Общая и неорганическая химия. Строение атома и периодическая система. Химическая связь и строение вещества Анализ лекарственных форм с витаминами и использование физико-химических и химических методов анализа. Вопросы стабилизации
Анализ лекарственных форм с витаминами и использование физико-химических и химических методов анализа. Вопросы стабилизации Простые вещества - неметаллы
Простые вещества - неметаллы Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Химические соединения в живых организмах. Неорганические вещества
Химические соединения в живых организмах. Неорганические вещества Кислоты. Оксиды
Кислоты. Оксиды Комбинаторика в химии
Комбинаторика в химии