Содержание
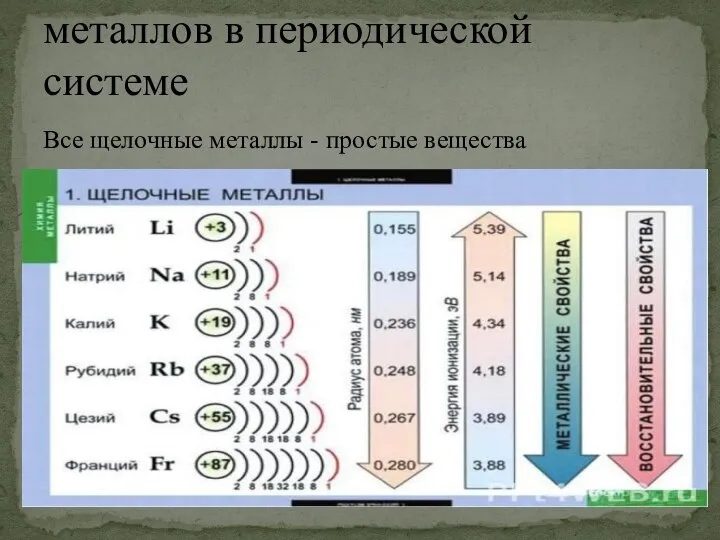
- 2. Расположение щелочных металлов в периодической системе Все щелочные металлы - простые вещества
- 3. Щелочны́е мета́ллы — это элементы 1-й группы периодической таблицы химических элементов по устаревшей классификации — элементы
- 4. В Периодической системе они следуют сразу за инертными газами, поэтому особенность строения атомов щелочных металлов заключается
- 5. Взаимодействие с водой. Важное свойство щелочных металлов — их высокая активность по отношению к воде. Наиболее
- 6. Литий. Самый легкий металл, имеет два стабильных изотопа с атомной массой 6 и 7; более распространен
- 7. Натрий. Известен с древности, выделил его Х.Дэви в 1807. Это мягкий металл, широко применяются такие его
- 8. Калий. Известен с древности, выделил его также Х.Дэви в 1807. Соли калия хорошо известны: калиевая селитра
- 9. Рубидий был открыт методом спектроскопии Р.Бунзеном в 1861; содержит 27,85% радиоактивного рубидия Rb-87. Рубидий, как и
- 10. Цезий. Соединения цезия широко распространены в природе, обычно в малых количествах совместно с соединениями других щелочных
- 12. Скачать презентацию








 Разбор домашнего задания
Разбор домашнего задания Классы веществ
Классы веществ Prezentatsia_Microsoft_PowerPoint (1)
Prezentatsia_Microsoft_PowerPoint (1) Соли и их свойства
Соли и их свойства Бытовая химия
Бытовая химия Строение электронной оболочки атома часть 2
Строение электронной оболочки атома часть 2 Состав и значение воздуха
Состав и значение воздуха Общая характеристика элементов А-группы
Общая характеристика элементов А-группы Химическая коррозия
Химическая коррозия Метод МО Хюккеля (МОХ)
Метод МО Хюккеля (МОХ) Чистые вещества и смеси
Чистые вещества и смеси Химические свойства классов неорганических соединений
Химические свойства классов неорганических соединений Ферменттер.Ферменттердің құрылымы.Биохимиялық маңызы
Ферменттер.Ферменттердің құрылымы.Биохимиялық маңызы Основные классы неорганических соединений
Основные классы неорганических соединений Основные особенности процессов растворения твёрдых веществ
Основные особенности процессов растворения твёрдых веществ Дождь из облака
Дождь из облака Физико-математические основы химии: Количество вещества, Молярная масса, Молярный объём, Число Авогадро
Физико-математические основы химии: Количество вещества, Молярная масса, Молярный объём, Число Авогадро Природные источники углеводородов
Природные источники углеводородов Как работают наночастицы серебра и меди. Вся продукция AgBionika
Как работают наночастицы серебра и меди. Вся продукция AgBionika Реакции поликонденсации
Реакции поликонденсации Арены. Понятие ароматичности. Правило Хюкклея. Круг Фроста
Арены. Понятие ароматичности. Правило Хюкклея. Круг Фроста Вещество и тело. Атом и молекула. Свойства веществ. Простые и сложные вещества. Химический элемент
Вещество и тело. Атом и молекула. Свойства веществ. Простые и сложные вещества. Химический элемент Простагландины. Воздействие фосфолипаз на фосфолипид
Простагландины. Воздействие фосфолипаз на фосфолипид Строение вещества
Строение вещества Химический анализ растворов этилового спирта черной смородины
Химический анализ растворов этилового спирта черной смородины Фестиваль песчаных скульптур
Фестиваль песчаных скульптур Диеновые углеводороды. Алкадиены
Диеновые углеводороды. Алкадиены Презентация на тему Законы газового состояния вещества
Презентация на тему Законы газового состояния вещества