Содержание
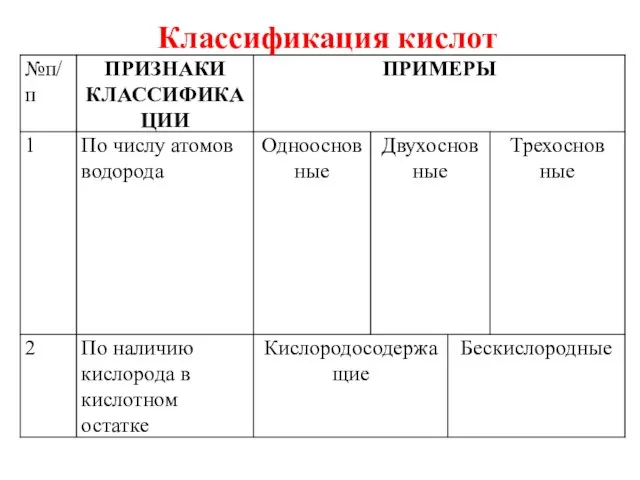
- 4. Классификация кислот
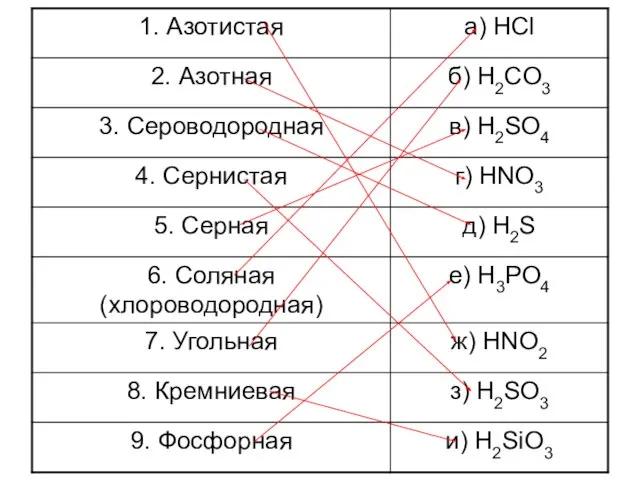
- 5. Кислоты, их классификация и свойства
- 6. Кислоты – это электролиты, при диссоциации которых в водных растворах в качестве катионов образуются ионы водорода,
- 7. Классификация кислот по признаку растворимости Угольная и сернистая кислоты в свободном виде не существуют, так как
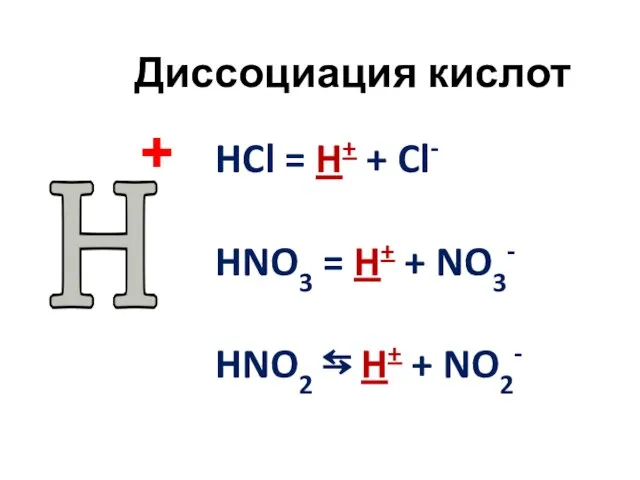
- 8. Диссоциация кислот HCl = H+ + Cl- HNO3 = H+ + NO3- HNO2 ⇆ H+ +
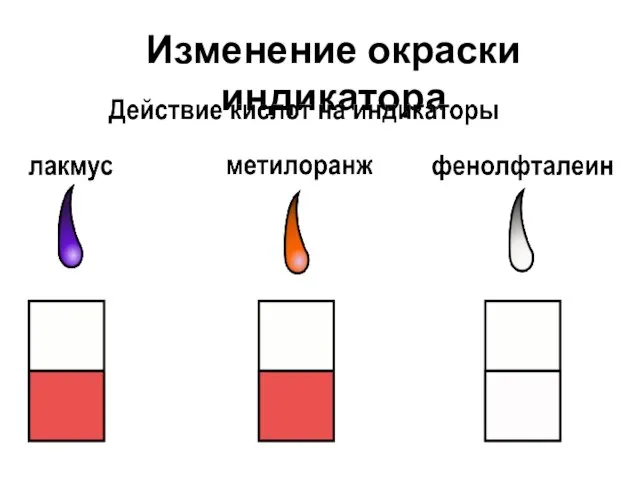
- 9. Изменение окраски индикатора
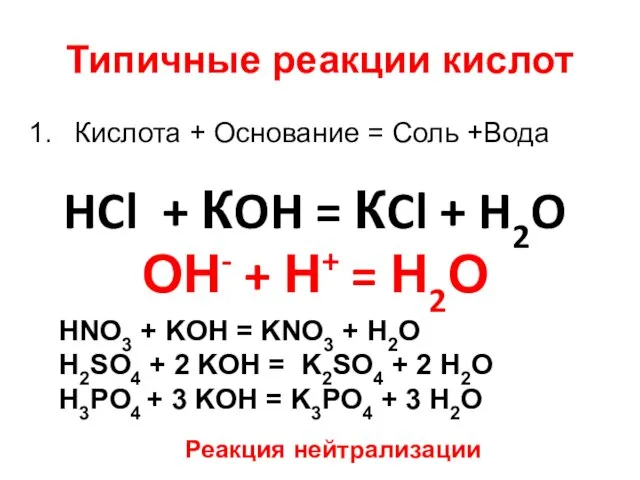
- 10. Типичные реакции кислот Кислота + Основание = Соль +Вода Кислота + Оксид металла = Соль +
- 11. Типичные реакции кислот Кислота + Основание = Соль +Вода HCl + КOH = КCl + H2O
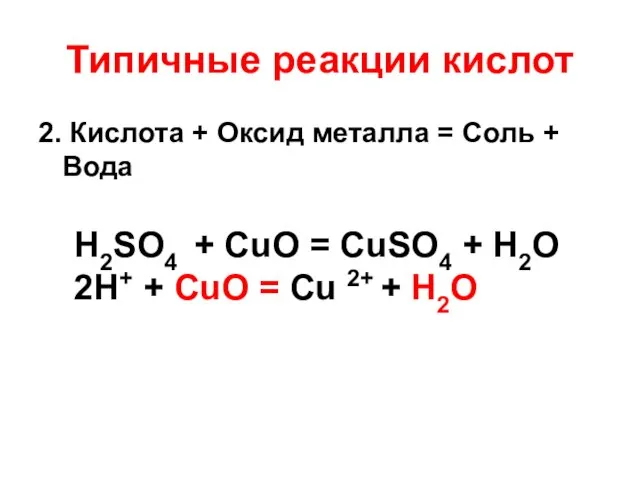
- 12. Типичные реакции кислот 2. Кислота + Оксид металла = Соль + Вода H2SO4 + CuO =
- 13. Типичные реакции кислот 3. Кислота + Металл = Соль + Водород 2HCl + Zn = ZnCl2
- 14. Вытеснительный ряд металлов Русский химик Н. Н. Бекетов исследовал металлы и расположил их в вытеснительный ряд
- 15. Для этих реакций необходимы условия: Металл должен находиться в ряду напряжений до водорода; Должна получиться растворимая
- 16. Типичные реакции кислот 4.Кислота + Соль = Новая кислота + Новая соль HCl + AgNO3 =
- 17. Запомните: Кислоты изменяют окраску индикаторов; Кислоты реагируют с основаниями; Кислоты реагируют с оксидами металлов; Кислоты при
- 18. Задание №1 1. Закончите схемы возможных реакций. Укажите их тип. а) H2SO4 + NaOH → …
- 20. Скачать презентацию











 Алкадиены: кумулированные, сопряженные, изолированные
Алкадиены: кумулированные, сопряженные, изолированные Комплексные соединения
Комплексные соединения Степень окисления (СО) – § 18
Степень окисления (СО) – § 18 8-9-10 химические формулы
8-9-10 химические формулы 175 – летию со дня рождения Дмитрия Ивановича Менделеева посвящается… АВТОР ПРЕЗЕНТАЦИИ: учитель химии МОУ СОШ №2 города Ртищево Саратовской области ПОПКОВА Е.Г.
175 – летию со дня рождения Дмитрия Ивановича Менделеева посвящается… АВТОР ПРЕЗЕНТАЦИИ: учитель химии МОУ СОШ №2 города Ртищево Саратовской области ПОПКОВА Е.Г. Термодинамика. Лекция №2
Термодинамика. Лекция №2 Презентация на тему "Водород"
Презентация на тему "Водород" Неметаллы в ПСХЭ
Неметаллы в ПСХЭ Презентация на тему Водород (9 класс)
Презентация на тему Водород (9 класс)  Эмульсия. Основные типы эмульсий
Эмульсия. Основные типы эмульсий Химический анализ
Химический анализ Биохимия, как наука
Биохимия, как наука Спирты, карбоновые кислоты
Спирты, карбоновые кислоты Осторожно, химия
Осторожно, химия Вуглеводні. Метан як представник насичених вуглеводнів
Вуглеводні. Метан як представник насичених вуглеводнів Оксиды и их свойства
Оксиды и их свойства Альдегиды. Кетоны
Альдегиды. Кетоны Минералы
Минералы Железо Fe
Железо Fe Способы получения металлов
Способы получения металлов Увлекательный мир химии
Увлекательный мир химии Оловянная чума
Оловянная чума Индолы. Cтроение индола
Индолы. Cтроение индола Патриотическое воспитание школьников на уроках
Патриотическое воспитание школьников на уроках AMFOTERNOST__1
AMFOTERNOST__1 Окисно-відновні реакції. Процеси окиснення та відновлення, окисники та відновники. 9 клас
Окисно-відновні реакції. Процеси окиснення та відновлення, окисники та відновники. 9 клас 5кл 20.10практична робота
5кл 20.10практична робота Презентация на тему Оксиды
Презентация на тему Оксиды