Содержание
- 2. Некоторые понятия химической кинетики. Химическая кинетика – раздел химии, изучаю- щий скорость и механизмы химических реакций.
- 3. Что такое химические реакции? Химические реакции – превращения одних веществ в другие, отличающиеся по составу и
- 4. Химические реакции протекают с разными скоростями. Быстрые реакции протекают в водных растворах с участием растворимых веществ;
- 5. Скорость гомогенной реакции определяется как изменение концентрации одного из веществ в единицу времени: Скорость гетерогенной реакции
- 6. Факторы, влияющие на скорость химической реакции. Природа реагирующих веществ Температура Концентрация реагирующих веществ Наличие катализатора (ингибитора)
- 7. В случае c HCl реакция пойдет быстрее, т.к. соляная кислота – сильная, а уксусная – слабая.
- 8. Температура Правило Вант-Гоффа: Повышение температуры на каждые 10 °С приводит к увеличению скорости реакции в 2–4
- 9. Пример 1: Если температурный коэффициент реакции равен 2, то при повышении температуры с 200С до 500С
- 10. Концентрация реагирующих веществ Математически зависимость скорости от концентрации для реакции выражается законом действующих масс. Т.е. скорость
- 11. Концентрация реагирующих веществ 2SO2 + О2 ⬄ 2 SO3 + Q Пример: Если в реакции давление
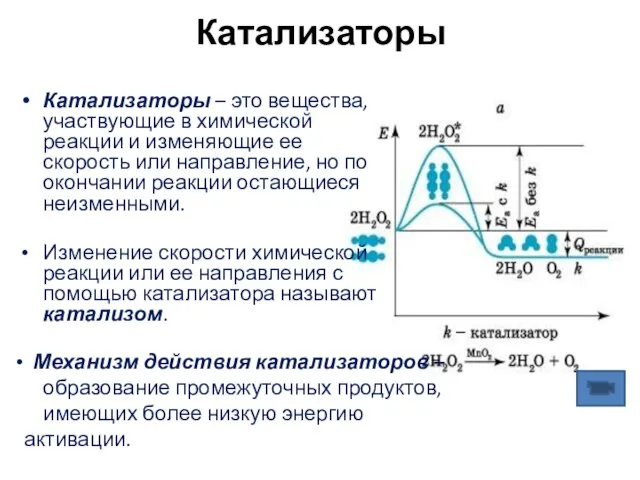
- 12. Катализаторы Катализаторы – это вещества, участвующие в химической реакции и изменяющие ее скорость или направление, но
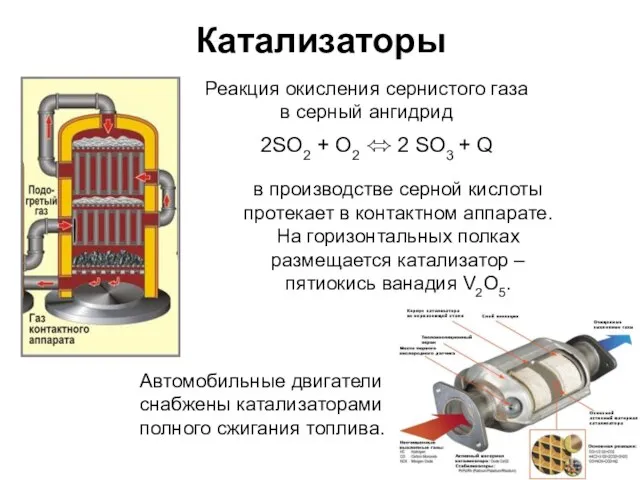
- 13. Катализаторы 2SO2 + О2 ⬄ 2 SO3 + Q Реакция окисления сернистого газа в серный ангидрид
- 14. Катализаторы Ферменты – биологически активные катализаторы. Используются в производстве детского питания, сыров, хлебопечении, виноделии и пивоварении.
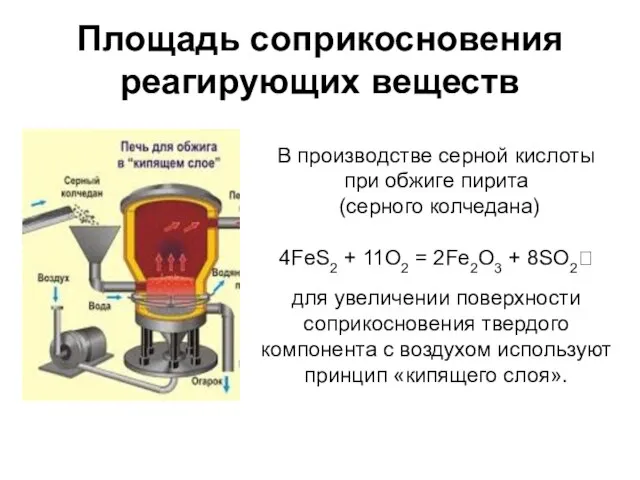
- 15. Площадь соприкосновения реагирующих веществ В каком случае реакция пойдет с бОльшей скоростью: Feкусковое + HCl ?
- 16. Площадь соприкосновения реагирующих веществ В производстве серной кислоты при обжиге пирита (серного колчедана) 4FeS2 + 11O2
- 18. Скачать презентацию












 Соединения железа
Соединения железа Биогенный элемент. Кобальт (Со)
Биогенный элемент. Кобальт (Со) Кроссворд по теме Металлы
Кроссворд по теме Металлы 01_Osnovnye_ponyatia_i_zakony_khimii
01_Osnovnye_ponyatia_i_zakony_khimii Ковалентная связь
Ковалентная связь Кислоты. Кислоты в животном мире
Кислоты. Кислоты в животном мире ИКТ как средство реализации проблемного обучения на уроках химии
ИКТ как средство реализации проблемного обучения на уроках химии Блок-схема функциональных элементов клеточного метаболизма
Блок-схема функциональных элементов клеточного метаболизма Свойства Н2
Свойства Н2 Органическая химия. Введение
Органическая химия. Введение Кислоты. Химический диктант. 8 класс
Кислоты. Химический диктант. 8 класс Полимерные материалы
Полимерные материалы Лиофильные и лиофобные дисперсные системы. Свойства лиофильных систем. Лекция 12
Лиофильные и лиофобные дисперсные системы. Свойства лиофильных систем. Лекция 12 Применение муравьиного спирта
Применение муравьиного спирта Классификация неорганический веществ
Классификация неорганический веществ Презентация на тему Валентность и степень окисления (8 класс)
Презентация на тему Валентность и степень окисления (8 класс)  Юный химик. Интерактивная интеллектуальная игра
Юный химик. Интерактивная интеллектуальная игра Hydroxidy. Vlastnosti
Hydroxidy. Vlastnosti Круговорот азота в природе
Круговорот азота в природе Кислоты и соли
Кислоты и соли Физические свойства минералов
Физические свойства минералов Углеводы. Классификация углеводов
Углеводы. Классификация углеводов Ұнтақтар - дәрілік түр ретінде
Ұнтақтар - дәрілік түр ретінде Спирты. Классификация, изомерия
Спирты. Классификация, изомерия Виды автомобильного топлива
Виды автомобильного топлива Исследование кокаина методом ГХ-МС
Исследование кокаина методом ГХ-МС Щелочноземельные металлы
Щелочноземельные металлы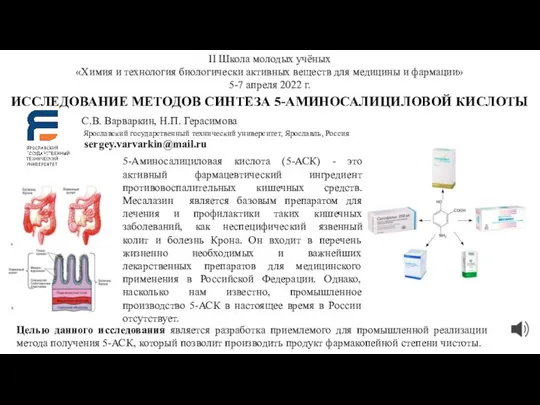 Исследование методов синтеза 5-аминосалициловой кислоты
Исследование методов синтеза 5-аминосалициловой кислоты