Содержание
- 2. В периодической таблице алюминий находится в третьем периоде, в главной подгруппе третьей группы. Заряд ядра +13.
- 3. Оксид алюминия – Al2O3. Физические свойства: оксид алюминия – белый аморфный порошок или очень твердые белые
- 4. Гидроксид алюминия – А1(ОН)3. Физические свойства: гидроксид алюминия – белый аморфный (гелеобразный) или кристаллический. Почти не
- 5. СОЛИ АЛЮМИНИЯ Из гидроксида алюминияможно получить практически все соли алюминия. Почти все соли алюминия и сильных
- 6. При взаимодействии с сильными щелочами образуются соответствующие алюминаты
- 7. Сульфат алюминия Al2(SO4)3.18H2O получается при действии горячей серной кислоты на оксид алюминия или на каолин. Применяется
- 9. Скачать презентацию






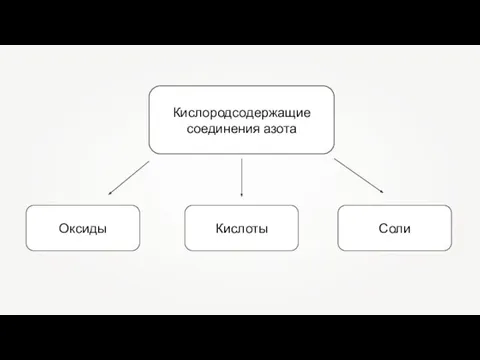 Кислородсодержащие соединения азота
Кислородсодержащие соединения азота Сложные эфиры
Сложные эфиры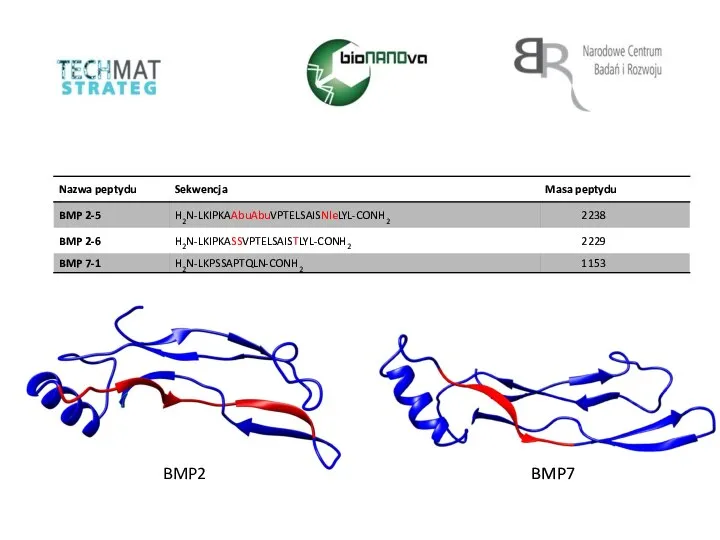 Nazwa peptydu. Sekwencja
Nazwa peptydu. Sekwencja Horenie
Horenie Практическая работа 1. ХТП. Классификация химических реакций
Практическая работа 1. ХТП. Классификация химических реакций Ацетиленовые углеводороды. Алкины
Ацетиленовые углеводороды. Алкины Знаки химических элементов. 8 класс
Знаки химических элементов. 8 класс Строение атома. Строение электронных оболочек атомов
Строение атома. Строение электронных оболочек атомов Хим-1 презент
Хим-1 презент Коррозия металлов
Коррозия металлов Геометрия молекул
Геометрия молекул Взаимодействие кислот с металлами. Кислоты-окислители
Взаимодействие кислот с металлами. Кислоты-окислители Алканы – строение, химические свойства
Алканы – строение, химические свойства Кабинет химии
Кабинет химии Основания. Определение. Формулы
Основания. Определение. Формулы Соли, их классификация и свойства
Соли, их классификация и свойства Презентация на тему Алкины
Презентация на тему Алкины  Сложные эфиры. Жиры
Сложные эфиры. Жиры Химия окислительновосстановительные реакции
Химия окислительновосстановительные реакции Химическая связь
Химическая связь Материалы в промышленности
Материалы в промышленности Графен. Нобелевская премия 2016
Графен. Нобелевская премия 2016 Химия в быту
Химия в быту Анализ катионов и анионов. Лекция № 2
Анализ катионов и анионов. Лекция № 2 Комплексные соединения
Комплексные соединения Типы химической связи
Типы химической связи Атомы химических элементов
Атомы химических элементов Получение и химические свойства металлов
Получение и химические свойства металлов